Vom Preis der Ignoranz
Nr. 8 einer Artikelreihe über die Ernährung
Ratgeber in Sachen Gesundheit weisen immer wieder darauf hin, wie wichtig es sei, „das Immunsystem zu stärken“ - insbesondere in der kalten Jahreszeit, in Erwartung der nächsten Grippewelle oder im Frühling, zu Beginn der Pollenflugsaison. Was für eine Farce!
Wenn man Reaktionen des Immunsystems überhaupt zur Kenntnis nimmt, versucht man, sie zu unterdrücken. Man nimmt Antibiotika, wenn man erkältet ist. Man nimmt Entzündungshemmer, wenn die Nase läuft. Man nimmt Abführmittel, wenn der Bauch weh tut. Der gemeinsame Nenner all dieser Maßnahmen ist, die körpereigene Abwehr zu schwächen, anstatt sie zu unterstützen – und das mit völliger Selbstverständlichkeit („Was soll man denn sonst machen?!“).
Für den Fall, dass kleine Kinder keine Milch vertragen, hat man sich einen Trick einfallen lassen, um das Immunsystem zu überlisten. Man verabreicht den Kindern die Milcheiweiße so klein zerstückelt, dass das Immunsystem sie nicht mehr bemerkt – und passieren lässt 1. Da Weizen ähnliche Probleme verursacht, experimentiert man bereits damit, die Klebereiweiße des Weizens gentechnisch so zu verändern, dass sie vom Immunsystem toleriert werden („Was soll man ihnen denn sonst geben?!“) 2.
Die Verdauungsprobleme der Kinder beginnen meist, sobald man ihnen die Erwachsenenkost verabreicht. Das ist ist bekannt. Doch es hat kaum jemanden dazu gebracht, sich Gedanken über die Erwachsenenkost zu machen („Irgendwann müssen sie eben lernen zu essen, was auf den Tisch kommt!“).
Die besagte Erwachsenenkost ist gewöhnlich denaturiert. Schon deshalb hält sie das Immunsystem in Atem 3. Oft hat es nur noch die Möglichkeit, sich im Schlaf zu erholen. Auch das ist bekannt. Doch es interessiert niemanden („Daran können wir sowieso nichts ändern!“).
Und nun soll ich mich „kalt duschen“, um mein Immunsystem zu stärken? Ich soll mich „ausgewogen ernähren“ (vielleicht von allem etwas?), „Stress abbauen“ (nichts leichter als das!), „genug schlafen“, und dergleichen mehr? Solche Ratschläge klingen eigenartig-naiv, weil sie das Offensichtliche beharrlich übersehen.
Wenn wir aber verstehen wollen, worum es hier geht, müssen wir erst einmal wissen, was das ist: das Immunsystem.
Das Immunsystem
Es ist gewöhnlich unbekannt. Es ist so unbekannt, dass man sich nicht einmal Gedanken darüber macht. Um so größer ist die Bestürzung, wenn es Probleme damit gibt.
Es ist genauso unbekannt wie wichtig. Denn der Körper ist ein offenes System, mittels Atmung, Ernährung und Berührung ständig mit einer aggressiven Umwelt verbunden. Sauerstoff ist hochreaktiv. Die Nahrung kommt aus lebendiger Materie (so sollte es jedenfalls sein), und Mikroorganismen stürzen sich auf alles, was zu leben aufgehört hat. Nur so ist Leben möglich. Das Immunsystem steht zwischen Körper und Umwelt, zwischen innen und außen. Es hat die Aufgabe, das Überleben des Organismus zu sichern. Ein effektives Immunsystem ist deshalb unentbehrlich – und deshalb hat es höchste Priorität, es zu verstehen.
Der Körper ist aber kompliziert; und das Immunsystem ist einer seiner komplizierteren Teile. Es besteht nicht nur aus Zellverbänden in Form von Organen und Geweben – wie die meisten anderen Systeme. Es hat darüber hinaus mobile Zellen, die im Körper unterwegs sind, sich wandeln und auf vielfältige Weise zusammenwirken – was eine fantastische Komplexität ergibt.
Das allgemeine System
Als Immunsystem (vom lat. „immunis“, heil, unversehrt) bezeichnet man das Abwehrsystem höherer Lebewesen.
- Es dient der Abwehr von Fremdstoffen und Pathogenen (vom grch. „pathos“, Leidenschaft; Leiden + „genes“, erzeugend, verursachend: Krankheitserreger). Fremdstoffe (z: B. Staub- oder Schmutzpartikel) sind zumindest belastend. Pathogene sind schädliche oder giftige Fremdstoffe (z. B. Pestizide aus Lebensmitteln oder Teer aus Zigaretten), Mikroorganismen (z. B. Bakterien oder Pilze) und Viren (z. B. Grippeviren).
- Es hat darüber hinaus die Aufgabe, aufgrund ihrer Lebensdauer verbrauchte, beschädigte oder kranke körpereigene Zellen zu beseitigen.
Die erste Verteidigungslinie soll verhindern, dass Pathogene überhaupt in den Körper eindringen 4, 5. So ist die Haut in erster Linie eine mechanische Barriere. Der „Säuremantel“ der gesunden Haut ist für Bakterien kaum zu durchdringen. Die Schleimhäute sondern Schleim ab und binden damit Fremdstoffe. Die Flimmerhärchen der Bronchien befördern Schleim und Fremdstoffe aus den Atemwegen. Die Magensäure zerstört fast alles, was an Mikroorganismen in den Verdauungstrakt gelangt. Die gesunde Darmflora ist ebenfalls an der Abwehr von Mikroorganismen beteiligt. Und natürlich werden über Darm und Harntrakt ständig Schlacken und Gifte aus dem Körper ausgeschieden.
Das Immunsystem im engeren Sinne umfasst verschiedene Organe und Gewebe sowie darin gebildete Moleküle und Zellen. Zu den primären Organen des Immunsystems gehören Leber und Knochenmark 5. In der Leber werden an die 30 Proteine gebildet, die in die Blutbahn abgegeben werden und im Körper zirkulieren. Sie bilden das Komplementsystem 6, 7.
Proteine des Komplementsystems können sich an Mikroorganismen heften. Einige sind in der Lage, die Zellwand zu durchdringen und den Eindringling zu töten. Andere lösen Entzündungen aus. Sie sorgen für eine Erweiterung der Blutgefäße, eine erhöhte Durchlässigkeit der Gefäßwände und eine Auflockerung des Gewebes, so dass weitere „Einsatzkräfte“ (siehe unten) leichter an den Ort des Geschehens gelangen können: Schwellung, Rötung und Überwärmung/Fieber - die primären Symptome der Entzündung. Andere markieren die Bakterien, Pilze oder was auch immer, so dass die weiteren Einsatzkräfte sie „erkennen“ (binden) können.
Die Bezeichnung „Komplement“ (Ergänzung) wurde 1890 von dem deutschen Arzt und Forscher Paul Ehrlich eingeführt, da er die Proteine als Ergänzung zu den sogenannten „Antikörpern“ (andere Proteine des Immunsystems) erkannte 7. Man spricht heute vom „Komplementsystem“, weil die Proteine als „System“ funktionieren. Ihre Reaktionen laufen stets kaskadenartig ab. Das heißt, das Pathogen löst die Reaktion des ersten Proteins aus. Die Reaktion des ersten Proteins löst die Reaktion des zweiten aus, die Reaktion des zweiten löst die Reaktion des dritten aus, usw. Die einzelnen Reaktionen sind sehr verschieden, sie laufen jedoch allesamt darauf hinaus, das Pathogen zu zerstören.
Das Komplementsystem ist Teil des allgemeinen (auch „angeborenen“ oder „unspezifischen“) Immunsystems, das schon sehr früh in der Entwicklungs-geschichte des Lebens entstand und sich seither weitgehend unverändert erhalten hat. Es ist in der Lage, viele Krankheitserreger bereits beim ersten Kontakt unschädlich zu machen.
Das Komplementsystem bildet die humoralen Faktoren (humoral: vom lat. „humor“, Flüssigkeit: Körperflüssigkeiten betreffend, in solchen befindlich) des allgemeinen Immunsystems (siehe Tabelle 1). Sie werden durch zelluläre Faktoren – die besagten weiteren Einsatzkräfte - ergänzt 8.
Tab. 1: Faktoren des allgemeines Immunsystems.
Die zellulären Faktoren des Immunsystems werden im Knochenmark gebildet, einer Substanz, die die Hohlräume („Markhöhlen“) der Knochen ausfüllt 9. Es gibt rotes und gelbes Knochenmark. Beim Neugeborenen ist das rote Knochenmark in den Markhöhlen fast aller Knochen vorhanden, beim Erwachsenen nur noch in Brustbein, Rippen, Schädelknochen, Schlüsselbeinen, Wirbelkörpern, Becken und stammwärts gerichteten Enden von Oberarm- und Oberschenkelknochen. Beim Erwachsenen besteht etwa die eine Hälfte des Knochenmarks aus rotem, etwa die andere Hälfte aus gelbem Knochenmark. Allein im roten Knochenmark finden sich blutzellenbildende Zellen; das gelbe Knochenmark besteht hauptsächlich aus Fett.
Die Blutzellen umfassen Erythrozyten (vom grch. „erythros“, rot + -zyt: Wortbildungselement mit der Bedeutung „Zelle“; auch „rote Blutzellen“ oder „rote Blutkörperchen“), Thrombozyten (vom grch. „thrombos“, Klumpen + -zyt: Zellen, die dem Verschluss von Verletzungen mittels Blutgerinnung dienen; auch „Blutblättchen“) 10 und last, not least Leukozyten (grch. „leukos“, hell, weiß: vom Aussehen her den Erythrozyten gegenübergestellt; auch „weiße Blutzellen“ oder „weiße Blutkörperchen“): die zellulären Faktoren des Immunsystems, auch „Immunzellen“ genannt 11.
Alle Blutzellen bilden sich aus undifferenzierten Stammzellen des Knochenmarks. Alle Immunzellen des allgemeinen Immunsystem entwickeln sich aus gemeinsamen Vorläuferzellen.
- Teil der Immunzellen des allgemeinen Immunsystems sind die Mastzellen. Die Bezeichnung rührt daher, dass sie auffällig dick sind: prall gefüllt mit Granula (lat. Körnchen), die wiederum entzündungsfördernde Stoffe enthalten. Die Mastzellen sitzen in Bindegeweben und Schleimhäuten. Pathogene aktivieren das Komplementsystem; das heißt, sie lösen die Spaltung bestimmter Proteine aus. Die so entstandenen Proteinfragmente aktivieren die Mastzellen; das heißt, es kommt zur Freisetzung der in den Granula gespeicherten Stoffe. Die Einwanderung weiterer Immunzellen in das infizierte Gewebe ist die Folge.
- Granulozyten enthalten charakteristische Granula, die sowohl entzündungsfördernde wie auch giftige Stoffe enthalten. Sie machen den Großteil der Leukozyten aus und kommen in verschiedenen Spielarten vor. Granulozyten sind an der Abwehr von großen Parasiten, z. B. Würmern, beteiligt. Proteinfragmente des Komplementsystems markieren die Parasiten; die Granulozyten binden an den Proteinfragmenten auf der Oberfläche der Parasiten; andere Proteinfragmente veranlassen die Granulozyten, ihren giftigen Inhalt zu entleeren; und die Würmer sterben ab. Granulozyten sind zum Teil auch in der Lage, kleinere Mikroben, z. B. Bakterien, in sich aufzunehmen und in ihre Bestandteile zu zerlegen.
- Dendritische Zellen (vom grch. „dendron“, Baum) haben zweigartige Zellfortsätze, mit denen sie Fremdkörper oder Pathogene umfassen können. Sie nehmen das Pathogen auf und zerlegen es in speziellen Organellen (Organelle: Verkleinerungsform von „Organ“; im Innern der Zelle).
- Makrophagen (vom grch. „makros“, groß + „phagein“, fressen; auch „Riesenfresszellen“) sind große Zellen, die fusionieren können, um auf diese Weise auch mit größeren Eindringlingen fertig zu werden.
Leukozyten, die wie (ein Teil der) Granulozyten, dendritische Zellen und Makrophagen in der Lage sind, Pathogene aufzunehmen (zu „fressen“) und im Zellinnern aufzulösen (zu „verdauen“), nennt man Phagozyten (vom grch. „phagein“ + -zyt, Wortbildungselement mit der Bedeutung „Zelle“; auch „Fresszellen“), ihre Fähigkeit Phagozytose (siehe Abbildung 1) 12, 13.
Abb. 1: Ein Phagozyt phagotisiert - ganz ungeniert.
Phagozyten erkennen Pathogene mittels der durch das Komplementsystem gesetzten Markierungen. Sie sind jedoch auch in der Lage, Krankheitserreger anhand spezifischer Merkmale der Erreger selbst zu erkennen. Es handelt sich dabei um Merkmale, die so eng mit dem Überleben der Erreger verbunden sind, dass sie auch über längere Zeit hinweg nicht verändert werden konnten (um etwa der Immunabwehr zu entgehen).
Solche Merkmale entsprechen molekularen Mustern der Oberflächenstruktur von Mikroorganismen. Die Phagozyten haben Rezeptoren (vom lat. „receptor“, Aufnehmer, Empfänger: „Andockstellen“) dafür entwickelt 14, 15. Es gelingt ihnen auf diese Weise, mit einer begrenzten Anzahl von Rezeptoren über eine begrenzte Anzahl von Grundmustern eine Vielzahl mikrobischer Strukturen zu erkennen.
Leukozyten bilden zahllose Botenstoffe, Zytokine (Zyt- + grch. „kinos“, Bewegung), um miteinander und mit ihrer Umgebung „zu kommunizieren“ 16. Sie verursachen damit Entzündungen, rufen Hilfe herbei und koordinieren ihr Vorgehen.
Wenn also irgendwelche Bakterien oder Fremdstoffe z. B. über eine Schürfwunde in die Blutbahn gelangen, kommt es mittels Komplementsystem und Mastzellen zu einer lokalen Entzündung. Granulozyten eilen herbei und fressen die Eindringlinge auf. Je nach Bedarf werden sie von anderen Phagozyten unterstützt, bis die Situation bereinigt ist. Reste der Aktion werden möglicherweise in Form von Eiter abgesondert.
Ausweispflicht
Eine grundlegende Voraussetzung für ein funktionierendes Immunsystem ist die Fähigkeit, zwischen Selbst und Nicht-Selbst zu unterscheiden. Das Selbst darf nur in bestimmten Fällen angegriffen werden, dann nämlich, wenn die Zelle verbraucht, beschädigt oder krank ist. Das Nicht-Selbst muss immer angegriffen werden, wenn es eine Gefahr für den Körper bedeutet.
Wirbeltiere ab den Knorpelfischen (z. B. Haie und Rochen) verfügen daher über einen Haupt-Histokompatilitäts-Komplex (Histo-: vom grch. „histos“, Gewebe; Kompatibilität: vom engl. „compatible“, zusammenpassend: das Zusammenpassen; die übliche Abkürzung MHC steht für das gleichbedeutende engl. „main histocompatibility-complex“) 17, 18, 19. Es handelt sich um einen Komplex von Genen des Zellkerns, die dafür sorgen, dass das Immunsystem eigenes und fremdes Gewebe identifizieren kann.
Die Genprodukte sind spezifische Glykoproteine („Zuckereiweiße“): die MHC-Moleküle. Sie werden nach dem Code (Bauplan) der beteiligten Gene in speziellen Zellorganellen zusammengesetzt, zur Membran transportiert und so in der Membran verankert, dass sie über deren Oberfläche hinausragen. Da die MHC-Moleküle von Mensch zu Mensch von verschiedenen Genen und vielen verschiedenen Abschnitten der betreffenden Gene codiert werden können, ist es sehr unwahrscheinlich, dass zwei Menschen identische MHC-Moleküle aufweisen. Sie sind daher für jeden Menschen einzigartig.
Es gibt zwei hauptsächliche Versionen des MHC: den MHC-I und den MHC-II – und somit auch MHC-I-Moleküle und MHC-II-Moleküle. Der MHC-I findet sich in allen kernhaltigen Körperzellen, die Immunzellen ausgenommen. MHC-I-Moleküle werden mit körpereigenen Peptiden beladen. (Peptid: vom grch. „pepton“, verdaut: ein kleines Protein mit nicht mehr als 100 Aminosäuren, auch Spaltprodukt der Verdauung; auf MHC-I-Molekülen finden sich Peptide mit einer Länge von acht bis zehn Aminosäuren.) Die präsentierten Peptide sind Abbilder der in den Zellen hergestellten Proteine. Körperzellen führen gewöhnlich also eine Art „Ausweis“ mit sich, anhand dessen sie als Mitglied ihres spezifischen Körpers identifizierbar sind (siehe Abbildung 2).
Erythrozyten und Thrombozyten sind keine vollständigen Zellen, indem sie keinen Zellkern haben. Sie verlieren ihn während ihrer Entwicklung. Deshalb haben sie keine Gene (die sich ja im Kern befinden); und deshalb können sie auch keine MHC-Moleküle hervorbringen. Sie haben stattdessen andere, ältere Erkennungsmerkmale, die sie vor der Immunabwehr des Körpers schützen, dem sie angehören.
Der Ausweis kann jedoch durch virale Infektionen beschädigt werden oder verloren gehen. Die entarteten Zellen weisen keine oder veränderte MHC-I-Moleküle auf. Hier kommen die natürlichen Killerzellen („NK-Zellen“) ins Spiel 20. Sie sind ständig unterwegs, um die Ausweise zu prüfen. Wo er auf einer Zelle fehlt, wird die NK-Zelle aktiv. Sie setzt Stoffe frei, die Löcher in die Zelle ätzen; und sie injiziert andere Stoffe in die Zelle, die ihren Tod herbeiführen. NK-Zellen sind somit die erste Verteidigungslinie gegen Pathogene, die es bis in Körperzellen hinein geschafft haben. Sie erfüllen eine wichtige Aufgabe bei der Eliminierung von Tumorzellen. Solange man es ihnen nicht allzu schwer macht, werden sie einem Krebs kaum eine Chance geben.
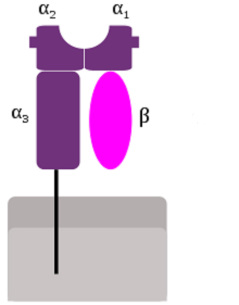
Abb. 2: MHC-I-Molekül. Der Proteinkomplex besteht aus einer größeren, an der Zellmembran verankerten Untereinheit, zusammengesetzt aus den „Domänen“ α1, α2, und α3, und einer kleineren, löslichen Untereinheit β. Die Domänen α1 und α2 bilden eine Grube, in die das Peptid eingebracht wird.
Das allgemeine Immunsystem schützt den Organismus für etwa vier bis fünf Tage. Es ist in der Lage, schätzungsweise 90 % aller Infektionen zu erkennen und erfolgreich zu bekämpfen. Ist die Infektion in dieser Zeit nicht behoben oder übersteigen die Pathogene einen bestimmten Schwellenwert, kommt es zu einer Aktivierung des spezifischen Immunsystems.
Fahndung
Das wesentliche Verbindungsglied zwischen dem allgemeinen und dem fortgeschritteneren spezifischen System ist der MHC. Während der MHC-I in den meisten Körperzellen vorhanden ist, gibt es den MHC-II ausschließlich in Leukozyten (zum MHC-II-Molekül siehe Abbildung 3).
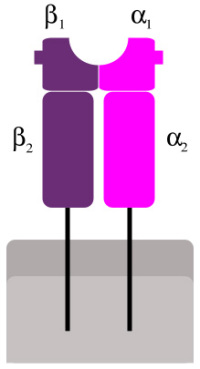
Abb. 3: MHC-II-Molekül. Der Protein-komplex besteht aus zwei etwa gleich großen membranverankerten Untereinheiten.
Wenn wir das MHC-Molekül mit einem Ausweis vergleichen, finden wir in der Tat, wie in jedem Ausweis, auch ein „Ausweisfoto“ darin. Im Falle der MHC-I-Moleküle stammt es aus dem intrazellulären, im Falle der MHC-II-Moleküle aus dem extrazellulären Raum. Die Immunzelle nimmt Proteine auf und zerlegt sie in den darauf spezialisierten Organellen. Einige der Fragmente werden – wie gehabt - in die dafür vorgesehene Spalte an der Oberseite des Moleküls eingefügt, bevor das Molekül in die Zellmembran eingebaut wird. Das Peptid wird so auf dem Hintergrund des Moleküls sichtbar.
Solange es keine Pathogene im extrazellulären Raum gibt, präsentiert die Zelle nur körpereigene Proteine. Das Ausweisfoto gibt keinen Anlass zur Beanstandung. Sobald jedoch Pathogene in die Zelle gelangen, erscheinen körperfremde Peptide auf dem Molekül.
Wichtiger als der „Ausweis“ selbst ist nun also das „Ausweisfoto“; und das Ausweisfoto ist im Falle einer Infektion ein „Fahndungsfoto“. Darauf abgebildet ist das Pathogen bzw. Antigen, das sich im extrazellulären Raum aufhält. Phagozyten („Fresszellen“) bringen solche Fahndungsfotos in Umlauf. Weitere Aktionen sind Sache des spezifischen Immunsystems.
Verkehrswege ...
Das spezifische Immunsystem ist eng mit dem Lymphsystem (auch „lymphatisches System“) verbunden 21. Es ist eine Entwicklung von Wirbeltieren, die ihre Bezeichnung - analog zum Blutsystem - von der Flüssigkeit hat, die sie als Transportstoff verwendet: der Lymphe (grch. klares Wasser; auch „Körperwasser“) 22.
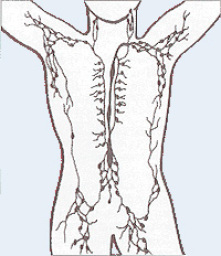
Das Lymphsystem besteht aus lymphatischen Organen und Lymphgefäßen, die in ihrer Gesamtheit das Lymphgefäßsystem bilden (siehe Abbildung 4) 23.
Abb. 4: Das menschliche Lymphgefäßsystem (Rumpf).
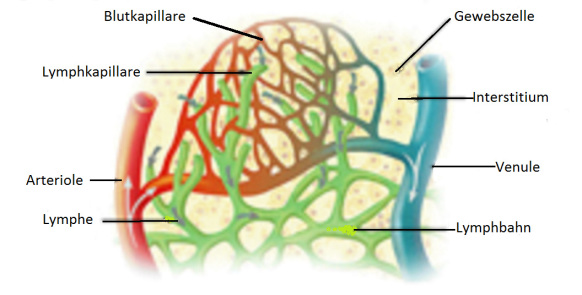
Das Lymphgefäßsystem ist neben dem Blutkreislauf das zweite Transportsystem des Körpers. Es ist eng mit dem Blutkreislauf verbunden, im Gegensatz zu diesem aber kein geschlossenes System. Es hat seine Quellen im Interstitium (lat. Zwischenraum: auch „Zellzwischenraum“): dem Raum, der zwischen allen sesshaften Zellen des Körpers liegt und diese verbindet.
Das Interstitium wird vom Blutkreislauf über die Blutkapillaren (vom lat. „capillaris“, einem Haar ähnlich; zu „capillus“, Haar; auch „Haargefäße“) gespeist. Die Kapillaren sind mikroskopisch kleine Gefäße, die die Verbindung zwischen dem arteriellen und dem venösen Teil des Blutkreislaufs darstellen. Ein Teil des Blutplasmas (der flüssige Teil des Bluts) gelangt aus den Kapillaren ins Interstitium. Es heißt nun Interzellularflüssigkeit (lat. „inter“, zwischen; auch „Gewebsflüssigkeit“).
Da zelluläre Anteile des Bluts die Kapillarwand nicht durchdringen, besteht die so erhaltene Flüssigkeit ausschließlich aus Wasser und darin gelösten Stoffen. Beides dient der Ernährung der Zellen und damit (in erster Linie) dem Stoffwechsel. Es wird entweder passiv, das heißt durch Zellporen, oder aktiv, das heißt durch Transportproteine, die in die Zellwand eingebaut sind, in die Zellen aufgenommen. Die Zellen geben auf umgekehrtem Wege ihre Stoffwechsel-rückstände ins Interstitium ab.
Auf diese Weise gelangen pro Tag etwa 20 Liter Gewebsflüssigkeit ins Interstitium. Etwa 18 Liter davon werden über die Blutkapillaren wieder ins Blut aufgenommen und über die Venen abgeleitet. Der Rest ist Sache der Lymphgefäße.
Das Lymphgefäßsystem beginnt blind mit den Lymphkapillaren (siehe Abbildung 5). Hier wird die Lymphe durch Aufnahme von Interzellularflüssigkeit gebildet. Die Wand der Lymphkapillaren weist relativ große Öffnungen auf, außerdem sind die Lymphkapillaren etwas größer als die Blutkapillaren, so dass sie in der Lage sind, Teilchen aufzunehmen und zu transportieren, die aufgrund ihrer Größe nicht direkt in den Blutkreislauf aufgenommen werden können. Das betrifft insbesondere Fett- und Eiweißmoleküle aus dem Darmtrakt, aber auch geronnenes Blut im Falle von Verletzungen und Pathogene im Falle von Infektionen. (Die Lymphe erscheint deshalb nach fettigen Mahlzeiten milchig-trübe.)
Abb. 5: Lymphkapillaren im „Kapillarbett“ des Blutsystems.
Die Lymphkapillaren vereinigen sich zu größeren Lymphgefäßen, in die Lymphknoten als Filterstationen für Fremdstoffe jeglicher Art eingebaut sind. Die Lymphgefäße schließen sich zu immer größeren Lymphstämmen und -gängen zusammen.
Die Lymphe wird zum Teil passiv, durch gewöhnliche Körperbewegungen, zum Teil aktiv, mit Hilfe von Lymphangionen (grch. „angeion“, Gefäß, Behälter), bewegt. Dabei handelt es sich um Lymphgefäßabschnitte mit verdickter Wand, die durch Ventilklappen begrenzt sind. Sie sind in die Lymphbahnen eingestreut und kontrahieren (ungeordnet) etwa 10-mal pro Minute. (Daher auch die Bezeichnung „Lymphherzen“ oder „Lymphherzchen“.)
Die großen Lymphgänge münden schließlich beidseitig im Bereich der Venenwinkel (die Vereinigung zweier großer Venen hinter dem Schlüsselbein) in das venöse System des Blutkreislaufs - wobei die Einmündung am linken Venenwinkel den weitaus größeren Einzugsbereich hat. (Die aus den Venenwinkeln resultierenden Venen führen in die obere Hohlvene, die das Blut aus der oberen Körperhälfte zum Herzen leitet.)
… und Einrichtungen des spezifischen Systems
Das Lymphsystem besteht aus Lymphgefäßsystem und lymphatischen Gewe-ben und Organen. Man unterscheidet zwischen primären und sekundären Orga-nen (siehe Tabelle 2). Die primären lymphatischen Organe sind Knochenmark und Thymus (vom gleichbed. grch. „thymos“, Brustdrüse).
Tab. 2: Lymphatische Gewebe und Organe.
Im Knochenmark werden alle Blutzellen aus gemeinsamen, noch undifferen-zierten Stammzellen gebildet. Aus einer Stammzelle entstehen jeweils eine weitere Stammzelle und eine spezifische Vorläuferzelle, die den Beginn der Entwicklungsreihe einer der verschiedenen Arten von Blutzellen darstellt.
Die Immunzellen entwickeln sich aus zwei verschiedenen Vorläuferzellen: den myeloiden und den lymphoiden Vorläuferzellen (myeloid: vom grch. „myelos“, Mark, Knochenmark + „-eides“ -förmig, -artig, gehörig zu: zum Knochenmark gehörig; lymphoid: zum lymphatischen System gehörig). Die Entwicklungsreihe der myeloiden Vorläuferzellen führt zu den Leukozyten des allgemeinen Immunsystems plus Thrombozyten. Die Entwicklungsreihe der lymphoiden Vorläuferzellen führt zu den Leukozyten des spezifischen Immunsystems: den Lymphozyten. (Die Erythrozyten haben ihre eigenen Vorläuferzellen.)
Die Leukozyten des spezifischen Immunsystems sind unmittelbar mit dem lymphatischen System verbunden. Daher die Bezeichnung „lymphoide Vorläuferzelle“; und daher die Beizeichnung „Lymphozyten“ für die daraus entstehenden Leukozyten. Eine Ausnahme sind die natürlichen Killerzellen (NK-Zellen). Sie gehören zum Stammbaum der Lymphozyten, werden aber aufgrund ihrer Funktionsweise zum allgemeinen Immunsystem gezählt.
Die Lymphozyten sind die zellulären Faktoren des spezifischen Immun-systems (siehe Tabelle 3). Sie werden von zwei Zelltypen gestellt. Typ eins sind die B-Lymphozyten (auch „B-Zellen“; das „B“ kam ursprünglich von der „Bursa Fabricii“, einem lymphatischen Organ am Enddarm von Vögeln, in dem die Zellen zum ersten Mal gefunden wurden; das lat. „bursa“ heißt soviel wie Tasche, Beutel; und entdeckt wurde der Beutel schon im 17. Jahrhundert von dem italienischen Arzt Girolamo Fabrizio; beim Menschen werden die B-Zellen allerdings im Knochenmark gebildet, weshalb das „B“ nachträglich die Bedeutung „bone marrow“, engl. Knochenmark, erhielt) 24, 25, 26.
Die Entwicklung der B-Zellen führt zur Ausbildung spezifischer Rezeptoren: B-Zell-Rezeptoren. Sie sind später dafür verantwortlich, dass die B-Zelle Antigene (wie man die Pathogene in diesem Zusammenhang oft nennt) passgenau erkennen kann.
Die Rezeptoren werden auf Grundlage mehrerer Gensegmente zusammengesetzt. Die Variation der Rezeptoren beruht auf der Variation der Verknüpfung von Ele-menten der verschiedenen Segmente. Die Variation der Verknüpfung erfolgt weitgehend nach dem Zufallsprinzip. Die fortgesetzte Neuverknüpfung lässt eine nahezu unbegrenzte Vielfalt von Rezeptoren entstehen, während jede Zelle nur Rezeptoren einer Spezifität aufweist. Die Antigenspezifität der Zelle (ihre Fähig-keit, ein spezifisches Antigen zu binden), wird allein durch die Spezifität ihres Rezeptors bestimmt. Auf diese Weise gibt es beim Menschen ungefähr 109 bis 1010 (bis zu zehn Milliarden) verschiedene B-Zellen, die sich allein in ihrem Re-zeptor unterscheiden.
B-Zellen, die während ihrer Entwicklung im Knochenmark mit körpereigenen Zellen reagieren, sterben gewöhnlich ab. Die restlichen verlassen das Knochen-mark über den Blutstrom in Richtung der sekundären lymphatischen Gewebe und Organe.
Tabelle 3: Faktoren des spezifischen Immunsystems.
Typ zwei der Lymphozyten umfasst die T-Lymphozyten (auch „T-Zellen“; das „T“ kommt vom „Thymus“; die T-Lymphozyten entstehen zwar wie die B-Lymphozyten im Knochenmark, schließen ihre Entwicklung aber im Thymus ab) 27.
Der Thymus sitzt beim Menschen oberhalb des Herzens, hinter dem Brustbein (siehe Abbildung 6) 28. Es ist ein zweilappiges Organ, wobei jeder Lappen beim Neugeborenen etwa 5 cm lang und 2 cm breit ist. Der Thymus wächst im Kindesalter noch etwas, hält seine Größe bis zur Pubertät bei und entwickelt sich dann zurück, wobei sein Gewebe zunehmend durch funktionsloses Fettgewebe ersetzt wird.
Abb. 6: Thymus (das Herz ist nicht eingezeichnet).
T-Lymphozyten-Vorläufer wandern aus dem Knochenmark über die Blutbahn in den Thymus ein. Hier werden sie auf ihre künftigen Aufgaben vorbereitet. Im ersten Schritt werden - wie im Falle der B-Zellen - spezifische Rezeptoren („T-Zell-Rezeptoren“) auf ihrer Oberfläche ausgebildet 29. Im Unterschied zu den B-Zell-Rezeptoren dienen sie aber nicht der Erkennung freier Pathogene. T-Zell-Rezeptoren haben die Funktion, auf MHC-Molekülen präsentierte Peptide (welcher Herkunft auch immer) zu erkennen. Mit anderen Worten, T-Zellen sind in der Lage, die von Körperzellen präsentierten „Ausweise“ zu prüfen und die „Fotos“ darin zu identifizieren.
Im zweiten Schritt werden zwei Klassen gebildet. Unterscheidungskriterien sind zwei weitere Rezeptoren („Co-Rezeptoren“): der CD-4-Rezeptor und der CD-8-Rezeptor („CD“ steht für engl. „cluster of differentiation“, eigentlich „Differenzierungsbündel“.) Es handelt sich um Glykoproteine („Zuckereiweiße“), die sich anhand von Molekülbündeln ihrer Struktur differenzieren lassen. Der CD-4-Rezeptor hat eine längliche Form mit vier hintereinander angeordnete Erweiterungen. Der CD-8-Rezeptor hat acht solcher Erweiterungen, die in zwei Reihen angeordnet sind 30, 31, 32.
- CD-4-Rezeptor: T-Zellen mit CD-4-Rezeptoren erkennen ausschließlich MHC-II-Moleküle, das heißt Antigen-Präsentationen anderer Immunzellen.
- CD-8-Rezeptor: T-Zellen mit CD-8-Rezeptor erkennen ausschließlich MHC-I-Moleküle, das heißt Antigen-Präsentationen anderer Körperzellen.
Anschließend werden T-Zellen, die thymuseigene peptidtragende MHC-Moleküle binden, für die weitere Nutzung ausgewählt (positive Auswahl). T-Zellen, die dazu nicht in der Lage sind, werden in den programmierten Zelltod geschickt; dasselbe gilt für T-Zellen, die zu starke Bindungen eingehen und deshalb gesunde Zellen „angreifen“ würden (negative Auswahl). Beide Auswahlverfahren zusammen gewährleisten die Produktion funktionstüchtiger reifer T-Zellen. Solche Zellen reagieren adäquat auf körperfremde Peptide und tolerieren körpereigene Peptide, die ihnen auf körpereigenen MHC-Molekülen präsentiert werden. Sie machen sich über die Blutbahn auf zu ihren „Stützpunkten“: den sekundären lymphatischen Geweben und Organen.
Nach Ausbildung eines umfangreichen Reservoirs an T-Zellen, bildet sich der Thymus zurück. Weitere Vermehrungen erfolgen nach Bedarf in den sekundären Organen.
Stützpunkte
Reife Lymphozyten wandern in die sekundären lymphatischen Gewebe und Organe ein, wo sie sich vorübergehend in deren Lymphfollikeln ansiedeln (Follikel: vom gleichbed. lat. „follicula“, Säckchen; zu „follis“, Sack, Beutel) 33, 34, 35. B-Zellen finden sich im Zentrum ein. Es heißt auch „Keimzentrum“, weil sie sich hier vermehren und differenzieren. In das Keimzentrum eingestreut sind Makrophagen („Riesenfresszellen“), die die Aufgabe haben, unbrauchbare B-Zell-Vorläufer zu beseitigen. Umgeben ist es von einer Rinde, bestehend aus T-Zellen, die über spezielle kleine venöse Blutgefäße einwandern.
Lymphfollikel gibt es vermehrt dort, wo vermehrt Pathogene kontaktiert werden. Das gilt insbesondere für die Schleimhäute. Einzelne Lymphfollikel findet man verstreut im gesamten Magen-Darm-Trakt; man nennt sie Solitärfollikel (über das frz. „solitaire“ vom gleichbed. lat. „solitus“, einzeln, allein). Sie haben kugelige Form, sind bis zu einigen Millimetern groß und können bei Entzündungen der Schleimhaut Stecknadelkopfgröße erreichen.
Zusammengelagerte Lymphfollikel bilden das mucosaassoziierte lymphatische Gewebe (Tunica mucosa: lat. „tunica“, Haut, Untergewand; „mucosa“, schleimig; zu „mucus“, Schleim; kurz „Mucosa“: Schleimhaut; assoziiert: vom lat. „associare“, sich zugesellen: zugehörig zu, verbunden mit; mucosaassoziiertes lymphatisches Gewebe: zur Schleimhaut gehöriges lymphatisches Gewebe; die Abkürzung MALT steht für das gleichbed. engl. „mucosa associated lymphatic tissue“).
Teil des MALT sind die Tonsillen (vom gleichbed. lat. „tonsillae“, die Mandeln im Halse) am Eingang sowohl des Atmungs- wie auch des Verdauungstrakts 36, 37. Sie bilden in ihrer Gesamtheit den lymphatischen Rachenring (auch Waldeyer-Ring, benannt nach dem deutschen Anatomen Wilhelm von Waldeyer).
Der lymphatische Rachenring besteht aus
- der paarigen Gaumenmandel: links und rechts vom „Gaumenzäpfchen“, auf Höhe der Zungenmandel,
- der unpaarigen Zungenmandel: oben hinten an der Zungenwurzel,
- der unpaarigen Rachenmandel: ganz am rückwärtigen Ende der Nasenhöhle, am sogenannten „Rachendach“ (da, wo der Rachen oben zu Ende ist); zum Abfangen von Keimen, die durch die Nase in den Körper gelangen,
- der paarigen Tubenmandel: am Eingang zum Tubus (lat. Röhre: Verbindung zwischen Nasenrachen und Mittelohr; auch „Ohrtrompete“); ebenfalls für Fremdkörper aus der Luft.
Zur Vergrößerung ihrer Oberfläche weisen die Mandeln Wülste und Vertiefungen auf, die ihnen ein zerklüftetes Aussehen geben. Die Lymphfollikel liegen direkt unter der Deckschicht der Schleimhaut. In der Deckschicht liegen M-Zellen (das „M“ steht für das engl. „microfold“, Mikrofalte [grch. „mikros“, klein]). M-Zellen bilden viele kleine Fältchen, die hier namensgebend waren 38. Sie nehmen Pathogene auf und leiten sie an die Follikel weiter.
Zum MALT gehören des weiteren die Peyer-Plaques (benannt nach ihrem Entdecker, dem Schweizer Arzt Johann Conrad Peyer [1653-1712]; auch GALT: für das engl. „gut associated lymapthic tissue“, darmassoziiertes lymphatisches Gewebe) 39. Es handelt sich um zusammenhängende Ansammlungen von jeweils 10 bis 50 Lymphfollikeln. Sie sind – neben Solitärfollikeln - im gesamten Dünndarm zu finden, am häufigsten im Ileum (neulat. Krummdarm: unterster, letzter Teil des Dünndarms) und im Appendix vermiformis (neulat. wurmförmiger Fortsatz; auch „Wurmfortsatz“: ein etwa 10 cm langes Anhängsel des Blinddarms) 40.
Wo die Follikel in die Dünndarmschleimhaut ragen, fehlen die sonst üblichen Zotten. Man findet stattdessen kleine, kuppelartige Strukturen, die sich in die Lichtung wölben. In der Deckschicht sitzen wiederum M-Zellen, die Pathogene aufgreifen und in das Innere der Follikel schleusen. Etwa 25 % der Darmschleimhaut sind lymphatisches Gewebe, und 70 bis 80 % aller B-Zellen des Körpers befinden sich im lymphatischen Gewebe der Darmschleimhaut 41, 42.
Weitere Teile des MALT sind u. a. das lymphatische Gewebe der Lunge, das BALT (Sie werden es erraten: für engl. „bronchial associated lymphatic tissue“, bronchienassoziiertes lymphatisches Gewebe) und des Urogenitaltrakts (Harn- und Geschlechtsapparat) 43.
Sekundäre lymphatische Organe sind Lymphknoten und Milz. Im Gegensatz zu Solitärfollikeln und lymphatischem Gewebe verfügen sie über ein eigenes Grund- und Stützgewebe 33. Die Lymphknoten – zugleich Teil des Lymphgefäßsystems - sind etwa 5 bis 10 mm große, erbsen- oder linsenförmige Gebilde 44. Am Hals und in der Leistengegend können sie bis zu 2 cm groß werden. Wenn sie größer sind, sind sie aktiv. Lymphknoten kommen überall im Körper außer im zentralen Nervensystem (Gehirn und Rückenmark) vor. Gehäuft findet man sie am Hals, in den Achseln und in den Leisten, wo sie als Sammelstellen für Lymphgefäße aus dem Kopf bzw. den Extremitäten fungieren (siehe Seite 7, Abbildung 4).
Jeder Lymphknoten ist dafür zuständig, die Lymphe einer bestimmten Körperregion aufzunehmen und zu filtern. Der Lymphknoten ist der „regionäre Lymphknoten“ des betreffenden Bereichs. Im Falle eines vergrößerten, entzündeten oder vereiterten Lymphknotens ist die Ursache folglich in diesem Bereich zu suchen.
Die Lymphknoten sind darüber hinaus die wichtigsten nachgeburtlichen Lymphozyten-Produzenten. Vergrößerungen weisen somit auch auf einen erhöhten Bedarf innerhalb des drainierten Bereichs hin.
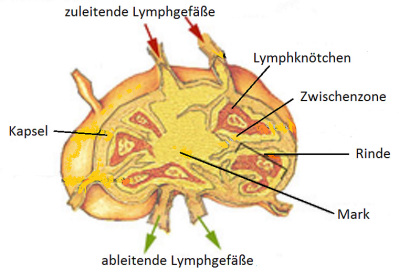
Der Lymphknoten ist von einer derben Kapsel umgeben, von der aus Bindegewebszüge ins Innere führen (siehe Abbildung 7). Kleine Gefäße stellen die Verbindung mit dem Blutkreislauf her. Die Lymphozyten treten über spezielle, gefensterte Venulen am Ausgang des Kapillarbetts aus dem Blutstroms aus, um den Lymphknoten zu besiedeln. Das funktionelle Gewebe des Lymphknotens besteht aus netzartig zusammengelagerten Zellen und freien Zellen. Es ist in drei Bereiche untergliedert.
- In der Rinde sind die Lymphozyten zu Rindenfollikeln (hier nennt man die Follikel auch „Lymphknötchen“) organisiert. Sie dienen der Vermehrung und Differenzierung von B-Zellen.
- Die Zwischenzone, die Zone zwischen den Rindenfollikeln, ist der T-Zell-Bereich.
- Das Mark besteht aus strangförmig angeordneten reifen B-Zellen (Markstränge), Makrophagen und bindegewebigen Zellen.
Die „Primärlymphe“ tritt über zuleitende Lymphgefäße in den äußeren Bereich des Lymphknotens ein, der von Phagozyten besiedelt ist. Nur ein kleiner Teil gelangt in das Innere des Lymphknotens, wo sich die Areale von B- und T-Zellen befinden. Über abführende Gefäße wird die Lymphe – nun „Sekundärlymphe“ genannt – wieder dem Lymphgefäßsystem zugeführt.
Abb. 7: Lymphknoten (die Blutgefäße sind nicht eingezeichnet).
Die Milz, im linken Oberbauch, nahe dem Magen gelegen, gehört sowohl dem Blut- wie auch dem Lymphsystem an (siehe Abbildung 8) 45. Sie enthält Lymphfollikel mit B- und T-Zellkolonien sowie große Mengen an Vorläuferzellen von Phagozyten und Thrombozyten. Sie hat ähnliche Aufgaben wie die Lymphknoten. Doch während ein Lymphknoten die Lymphe einer bestimmten Körperregion filtert, ist die Milz für die gesamte Blutbahn zuständig. Darüber hinaus fischt sie überalterte Erythrozyten aus dem Blut. Letztere verlieren mit der Zeit an Flexibilität und verfangen sich dann in den engen Maschen ihres Bindegewebes. Sie werden aussortiert, anschließend von Phagozyten beseitigt.
Lymphozyten stellen die spezifische Immunreaktion. Ihre Reaktion ist spezifisch, indem sie nur das Antigen/Pathogen binden, das zu ihrem Rezeptor passt – wie der Schlüssel zum Schloss. Die Anzahl einer bestimmten B- oder T-Zelle ist daher begrenzt. Die Natur hat das Problem gelöst, indem sie einen Teil der Lymphozyten über Blut und Lymphe durch die lymphatischen Organe zirkulieren lässt. Die Lymphozyten verwenden das Blut, um zu ihren Stützpunkten und Einsatzorten zu gelangen; über die Lymphe kehren sie wieder ins Blut zurück. Im Durchschnitt kreisen etwa 5 % der Leukozyten im Blut. Der Rest ist auf alle anderen Gewebe verteilt.
Abb. 8: Milz.
Strategien des spezifischen Systems
Dendritische Zellen sind fast überall im Körper, vor allem in den Deckschichten von Haut und Schleimhäuten, als Wächterzellen postiert. Wenn sie Pathogene kontaktieren, nehmen sie sie auf, zerlegen sie und präsentieren daraus erhaltene Peptide auf MHC-I- oder MHC-II-Molekülen (dendritische Zellen sind die einzigen Zellen, die beide Arten von MHC-Molekülen produzieren können). Dann begeben sie sich auf den anfänglichen Lymphbahnen zum drainierenden Lymphknoten, um sich dort niederzulassen.
Zirkulierende naive T-Zellen (die noch keinen Antigenkontakt hatten) treten über die Venulen des Kapillarbetts in den Lymphknoten ein. Sie schlendern durch die Zwischenzone, wo sie die neu angekommenen dendritischen Zellen treffen. Sie schauen sich deren MHC-Moleküle an, und wo ein CD-4-Rezeptor zu einem MHC-II/Peptid-Komplex passt, wird ein T-Lymphozyt aktiviert. Die aktivierten Zellen – Effektor-Zellen nennt man sie – vermehren sich und differenzieren zu T-Helferzellen und T-Gedächtniszellen. Die Helferzellen kommen sogleich zum Einsatz (und werden sich dabei verbrauchen), die Gedächtniszellen sind relativ langlebig und werden bei einem erneuten Antigenkontakt sofort aktiv 46.
B-Zellen, die das kursierende Pathogen/Antigen ebenfalls erkannt haben und seine Peptide auf MHC-II-Molekülen präsentieren, werden in der Zwischenzone des Lymphknotens von den T-Helferzellen aufgehalten und aktiviert (daher „Helferzellen“). Die aktivierten B-Zellen lassen sich in den Keimzentren nieder. Hier vermehren sie sich und werden zu Plasmazellen (Plasma: vom grch. „plasma“, was gebildet worden ist: der flüssige Anteil der Zelle oder des Bluts; die Plasmazelle enthält auffallend viel Zellplasma; daher die Bezeichnung) 47.
Die Plasmazelle (B-Effektor-Zelle) sondert Antikörper ab, die dieselbe Spezifität haben wie ihr membranständiger Rezeptor, das heißt dasselbe Antigen binden 19. Der Antikörper ist also eine freie Version des B-Zell-Rezeptors. Die Wirkung des Antikörpers besteht darin, das Antigen zu neutralisieren, kennzeichnen oder zerstören. Man spricht in diesem Zusammenhang von Antigen-Antikörper-Paaren. Das Antigen (vom grch. „anti“, dagegen + „genes“, hervorbringend; zu „gennai“, erzeugen, hervorbringen) ist also ein Pathogen, das eine Antikörper-Reaktion hervorruft. Es handelt sich in der Regel um artfremdes Eiweiß.
Antikörper werden auch Immunglobuline genannt (Immun- + lat. „globulus“, Verkleinerungsform von „globus“, Kugel: eigentlich also „Immunkügelchen“; kurz „Ig“). Es sind Glykoproteine unterschiedlichster Bauart. Sie lassen sich dennoch verschiedenen Klassen (und Unterklassen), sogenannten Isotypen (vom grch. „isos“, gleich: „Versionen des Gleichen“), zuordnen.
- IgM („Immunglobulin M“) wird insbesondere in der frühen Phase einer Immunreaktion gebildet und ist hauptsächlich im Blut zu finden. Es ist relativ groß und hat aufgrund seiner Struktur die stärkste Antigen-Bindungsfähigkeit aller Antikörper. Da IgM sehr rasch wieder verschwindet, deutet das Vorhandensein einer messbaren Menge auf eine soeben stattfindende Infektion hin.
- IgG tritt insbesondere bei sekundären und weiteren Immunreaktionen auf. IgG-Antikörper sind in Blut und Gewebsflüssigkeit feststellbar und machen gewöhnlich den Großteil der zirkulierenden Immunglobuline aus. Sie treten leicht aus den Blutgefäßen aus und sind außerdem plazentagängig, das heißt, sie gelangen bei Schwangerschaft über die Plazenta in den Blutkreislauf des Fötus.
- IgA wird insbesondere in den Lymphfollikeln der Schleimhäute hergestellt. IgA hat die Aufgabe, die Anlagerung von Bakterien oder Viren auf Deckgeweben zu verhindern. Es findet sich darüber hinaus in vielen Sekreten des Körpers, z. B. Speichel, Schweiß und Tränen. Die Anwesenheit von IgA im Colostrum (lat. die erste Milch einer stillenden Mutter) schützt das Neugeborene vor Infektionen des Magen-Darm-Trakts.
- IgE kommt im Gegensatz zu den anderen Isotypen hauptsächlich membranständig (und zwar auf Leukozyten des allgemeinen Immunsystems) vor. In seiner freien Form ist es nur in geringsten Mengen im Blut feststellbar. Es dient eigentlich der Abwehr von Wurminfektionen, tritt typischerweise jedoch im Zusammenhang mit Allergien wie Heuschnupfen, Asthma, Kuhmilch- und Weizenallergien auf.
Isotypenwechsel (z. B. von IgM zu IgG) werden von Zytokinen der T-Zellen veranlasst (siehe Seite. 5). Für einige Antigene gibt es T-Zell-unabhängige Aktivierungen. Das betrifft insbesondere Polysaccharide („Vielfachzucker“) auf der Oberfläche von Bakterien. Hier genügt ein Kontakt des B-Zell-Rezeptors mit dem Antigen. Die B-Zelle wird dadurch aktiviert, vermehrt sich und scheidet Antikörper der Klasse IgM aus. In diesen Fällen gibt es aber keine Isotypenwechsel; es werden auch keine B-Gedächtniszellen gebildet – die ansonsten ebenso wie die T-Gedächtniszellen bei wiederholter Infektion eine schnellere Reaktion ermöglichen 46.
Naive CD8-T-Zellen (zuständig für intrazelluläre Antigene) brauchen eine aufwendigere (und entsprechend schwerer verständliche) Aktivierung. Eine Schlüsselrolle dabei spielen die dendritischen Zellen – mit der Fähigkeit, Antigene aufzunehmen und sowohl auf dem MHC-II- wie auch MHC-I-Weg zu bearbeiten.
- Im ersten Fall nehmen sie das extrazelluläre Antigen auf und verarbeiten es als solches; die daraus erhaltenen Peptide werden als Repräsentationen des extrazellulären Antigens auf MHC-II-Molekülen dargeboten.
- Im zweiten Fall schleusen sie das extrazelluläre Antigen in das zentral liegende Zellplasma ein, wo es als intrazelluläres Antigen behandelt wird; die gleichen Peptide erscheinen nun auch als Repräsentationen eines intrazellulären Antigens auf MHC-I-Molekülen.
Nehmen wir an, eine bestimmte Menge eines Virus gelangt bei einer Verletzung in den Körper. Das Virus wird zum Teil von dendritischen Zellen abgefangen. Sie nehmen das Virus auf, verarbeiten es und laden die daraus erhaltenen Peptide auf MHC-I- und MHC-II-Moleküle.
Nun verlassen sie ihre Position im Gewebe und ziehen zum drainierenden Lymphknoten, wo sie sich im T-Zell-Bereich ansiedeln. Hier präsentieren sie vorbeiziehenden naiven T-Zellen (beider Spezies) ihre peptidbeladenen MHC-Moleküle. Es kommt zur Aktivierung von CD4- und CD8-T-Zellen mit den entsprechenden Rezeptoren an MHC-II/Peptid- bzw. MHC-I/Peptid-Komplexen.
CD8-T-Zellen brauchen jedoch noch ein weiteres Signal. Es muss von aktivierten CD4-T-Zellen kommen. Die CD8-Zelle erhält das Signal von der CD4-Zelle, indem sie an einem MHC-II/Peptid-Komplex und die CD4-Zelle an einem MHC-I/Peptid-Komplex ein und derselben dendritischen Zelle bindet. Die aktivierte CD8-T-Zelle heißt zytotoxische T-Zelle (zytotoxisch: zyto- + grch. „toxikon“, Gift: „zellgiftig“) 48.
Das Ziel des Virus sind die Zellen des Organismus. Viren, denen es gelingt, in Zellen einzudringen, verändern deren Proteinproduktion. Die infizierten Zellen präsentieren daher die gleichen Peptide auf ihren MHC-I-Molekülen wie die dendritischen Zellen, an der die T-Zellen aktiviert wurden. Die infizierten Zellen sind das Ziel der zytotoxischen T-Zellen – der eigentlichen Elite der körpereigenen Abwehr.
Der Angriff der zytotoxischen T-Zelle auf die Zielzelle beginnt mit der Erkennung des MHC-I/Peptid-Komplexes auf deren Oberfläche. Die T-Zelle bindet am MHC-I/Peptid-Komplex der Zielzelle. Sie schüttet Granula aus, deren Inhaltsstoffe den zytotoxischen Prozess einleiten. Ein Membranmolekül der T-Zelle interagiert mit einem korrespondierenden Molekül der Zielzelle und führt deren program-mierten Zelltod herbei. Eine einzelne zytotoxische T-Zelle kann mehrere Zielzellen eliminieren.
Regulatorische T-Zellen überwachen die Immunreaktionen. Sie sorgen für konstante Mengen von Leukozyten. Und sie gewährleisten, dass einerseits Krankheitserreger und kranke Zellen abgetötet werden, andererseits gesundes Gewebe nicht angegriffen wird.
Erworbene Defekte
„Alle lymphatischen Organe dienen der Abwehr. Nach der Lage der Mandeln ist anzunehmen, dass sie der Abwehr von Infektionen dienen, die über Mund oder Nase in den Körper eindringen.
Früher hatte man die Mandeln als direkte Kampfstätten angesehen. Vom Feind erstürmte Festungen vernichtet man, damit sie nicht ein Bollwerk des Feindes werden können. Entsprechend hat man vereiterte Mandeln entfernt ... Da praktisch jeder Mensch … eine Mandeleiterung in der Kindheit durchmacht, gab es bei uns vor einiger Zeit nur noch wenige Erwachsene mit Gaumenmandeln.
Die neueren Erkenntnisse über die Funktion der Lymphozyten lassen die Mandeln nicht mehr als direkte Kampfstätten, sondern als Informationsorgane sehen. In ihnen werden vermutlich eindringende Bakterien usw. identifiziert und Abwehrmaßnahmen des Gesamtkörpers ausgelöst (Bildung spezifischer Antikörper usw.). ,Grenzkontrollenʻ sind zwar lästig, aber für die Sicherheit des Organismus nötig. Man sollt daher die Mandeln nicht leichtfertig entfernen“ (Lippert 2000).
Ähnliches gilt für den Wurmfortsatz, als Anhang des Blinddarms am Übergang vom Dünndarm zum Dickdarm gelegen. Es gibt sicherlich Fälle, wo eine Entfernung vereiterten Gewebes notwendig oder sogar dringend notwendig ist. Doch Stützpunkte des Immunsystems sind damit unwiederbringlich verloren.
Es sind stets drastische und unangenehme Eingriffe - und sie haben eine Ähnlichkeit damit, seine Hunde zu erschießen, wenn sie anschlagen.
Das „fehlerhafte“ System
Es gibt auffallend viele Störungen und Krankheiten des Immunsystems. Das System hat zwei Aufgaben: erstens gefährliche Fremdstoffe und zweitens verbrauchte oder kranke Körperzellen zu eliminieren. Funktionsstörungen des Systems führen folglich dazu, dass harmlose Fremdstoffe und/oder gesunde Körperzellen angegriffen werden. Im ersten Fall sprechen wir von Allergien, im zweiten von Autoimmunreaktionen (grch. „autos“, eigen).
Das Wort Allergie (vom grch. „allos“, anderer + „ergeia“, Kraft; im Unterschied zur „Energie“: grch. „en-“, in, innerhalb) hebt darauf ab, dass die treibende Kraft außerhalb des Körpers liegt: dass es um Reaktionen auf körperfremde Stoffe geht 49. Die allergische Reaktion geht mit typischen, meist entzündlichen Symptomen einher. Betroffen sind vor allem die Haut, bsw. der Wangen oder Armbeugen, und die Schleimhäute, bsw. der Atemwege oder des Magen-Darm-Trakts.
Es gibt verschiedene Arten der Allergie 50, 51. Die klassische ist die Soforttyp-Allergie. Da sie 90 % aller allergischen Vorkommnisse ausmacht, wird sie oft als Allergie im engeren Sinne angesehen. Sie stellt ein beträchtliches Gesundheitsproblem, insbesondere in den westlichen Industrieländern, dar. Schätzungsweise bis zu 25 % der Bevölkerung sind davon betroffen.
Voraussetzung für die Soforttyp-Allergie ist ein Erstkontakt mit dem Allergen, der gewöhnlich symptomlos verläuft, jedoch zu einer Sensibilisierung hinsichtlich des Allergens führt. T-Helferzellen kontaktieren das Allergen und schütten einen Botenstoff aus, der B-Zellen dazu veranlasst, spezifische IgE-Antikörper zu produzieren. IgE hat jedoch die Eigenheit, weniger im Blut zu zirkulieren als sich im Gewebe niederzulassen (siehe oben). Es bindet daher an entsprechende Rezeptoren auf der Oberfläche von Mastzellen und (bestimmten) Granulozyten. Die Antikörper können auf diese Weise, jeweils zu zweit, ein Antigen einfangen und neutralisieren – was jedoch beim Erstkontakt kaum der Fall ist.
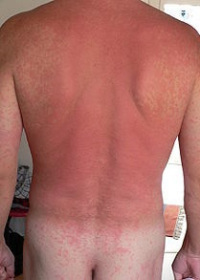
Die allergische Reaktion tritt beim zweiten und jedem weiteren Kontakt mit dem Allergen ein. Die massenweise auf den Mastzellen und Granulozyten sitzenden IgE-Antikörper – es können bis zu 50.000 auf einer einzigen Zelle sein - fangen das Antigen ein und bringen die Zelle dazu, ihre Inhalte auszuschütten. Letztere bestehen u. a. aus Entzündungsstoffen (z. B. Histamin), die innerhalb von Sekunden oder Minuten zur allergischen Reaktion führen: Die Blutgefäße werden durchlässiger, die Gefäßmuskulatur erschlafft, und die in der Haut gelegenen Nervenendigungen werden stimuliert - was einen Juckreiz hervorruft.
Abb. 9: Allergischer Hautausschlag.
Mastzellen und Granulozyten sitzen überwiegend in den Geweben entlang der Körperoberflächen: in der Haut, in der Bindehaut des Auges, in der Schleimhaut der Atemwege und des Magen-Darmtrakts sowie im Bindegewebe um die Blutgefäße. Daher das typische Erscheinungsbild (siehe Abbildung 9).
Allergien dieser Art sind:
- Allergische Rhinitis (Rhinitis: vom grch. „rhis“, Nase + -itis, Wortendung mit der Bedeutung „Entzündung“; auch „Schnupfen“; allergische Rhinitis: auch „Heuschnupfen): Entzündung der Nasenschleimhaut, oft verbunden mit Entzündungen der Nasennebenhöhlen und Asthma.
- Allergische Konjunktivitis (neulat. „tunica conjunctiva“, Bindehaut; auch „Bindehautentzündung“): verstärkte Durchblutung und damit Rötung der Bindehaut des Auges, Schwellung der Bindehaut, Verengung der Lidspalte, vermehrter Tränenfluss.
- Urtikaria (lat. „urtica“, Brennessel; auch „Nesselsucht“): ein an Bren-nesselkontakt erinnernder Hautausschlag mit Rötungen, Quaddeln und starkem Jucken. Große Teile der Körperoberfläche können betroffen sein. (Der 1. Oktober 2014 wurde zum ersten Welt-Urtikaria-Tag ausgerufen – was wohl den Leidensdruck der Betroffenen zum Ausdruck bringt.)
- Allergisches Asthma (Asthma: grch. Atemnot): chronische Entzündungen der unteren Atemwege. Es kommt zu anfallsweiser Atemnot infolge von Verengungen der Atemwege durch vermehrte Schleimabsonderung, Verkrampfung der Bronchialmuskulatur und Bildung von Ödemen der Bronchialschleimhaut 52.
- Angioödem (vom grch. „aggeion“, Blutgefäß + „oidema“, Schwellung; auch „Quincke-Ödem“, nach dem deutschen Arzt Heinrich Quincke): sich rasch entwickelnde Schwellungen von Haut, Schleimhäuten und angrenzendem Gewebe, beruhend auf einer plötzlich erhöhten Durchlässigkeit der Gefäßwände. Im Gegensatz zur Urtikaria sind auch tiefere Gewebe und die Darmwand betroffen. Bei einer Beteiligung der Atemwege kann es zu lebensbedrohlicher Atemnot kommen.
- Anaphylaktischer Schock (anaphylaktisch: vom grch. „ana“, gemäß, entsprechend + „phylaxis“, Schutz): Reaktionen, angefangen von leichten Hautrötungen über Störungen von Organfunktionen bis hin zum Kreislaufschock mit Organversagen und tödlichem Kreislaufversagen.
Es gibt auch andere Arten der Allergie. Bei der zytotoxischen Reaktion (zyto- + grch. „toxikon“, Gift: „zellgiftig“) sind körperfremde Antigene direkt an Zellen gebunden. Ein Beispiel ist die Blutgruppenunverträglichkeit. Blutgruppe A trägt Antikörper gegen Blutgruppe B mit sich und umgekehrt. Bei einer Transfusion von unverträglichem Blut binden körpereigene Antikörper an der Membran der fremden Erythrozyten – wo sie die entsprechenden Antigene vorfinden. Je nach Menge der Transfusion bilden sich vor Ort Gerinsel, oder die gebundenen Erythro-zyten werden in der Milz aussortiert und von Makrophagen beseitigt.
Bei der Bildung von Immunkomplexen binden Antikörper an freie Antigene. Beides ballt sich zusammen und liegt im Gewebe herum. Das Komplementsystem wird aktiv. Es löst die Komplexe auf, zerstört dabei aber auch das umliegende Gewebe. Das ist das Fall bei Entzündungen der Gelenke (Arthritis: grch. „arthron“, Glied; Gelenk), der Blutgefäße (Vaskulitis: lat. „vas“, Gefäß) oder der Nieren (Nephritis: grch. „nephros“, Niere).
Die auslösenden Allergene sind manchmal bekannt, manchmal nicht. Der Begriff der Allergie beruht jedoch auf zwei Grundannahmen; und die erste besteht darin, dass das Allergen „normalerweise harmlos“ sei. Eine typische Definition: „Als Allergie … wird eine überschießende Abwehrreaktion des Immunsystems auf be-stimmte und normalerweise harmlose Umweltstoffe (Allergene) bezeichnet ...“ 49.
Die Idee geht bis auf denjenigen zurück, der den Begriff 1906 eingeführt hat: Clemens von Pirquet. Er definierte die Allergie als „veränderte Fähigkeit des Körpers, auf fremde Substanz zu reagieren“ 49, 53. Daran hat sich nichts mehr geändert.
Grundannahme eins hat zur Grundannahme zwei geführt: dass das Immunsystem extrem störungsanfällig oder fehlerhaft sei. Wir lesen: „Gelegentlich kann das Immunsystem nicht zwischen schädlichen und unproblematischen Substanzen unterscheiden und wehrt sich plötzlich gegen harmlose Stoffe, die zum Beispiel in Pollen oder Nüssen vorkommen.“ - „Bei einer Allergie handelt es sich um eine Fehlfunktion des Immunsystems, das eine Reaktion auf normalerweise harmlose Substanzen … auslöst.“ - „Im Falle einer Allergie reagiert das Immunsystem unangemessen heftig auf eher harmlose Substanzen wie z. B. Pollen, Tierhaare oder Nahrungsmittel. Warum das Immunsystem derart überreagiert, ist bis heute nicht völlig geklärt.“ - usw.
Zum Glück ist das nur die halbe Wahrheit. Das letzte der obigen Zitate enthält den entscheidenden Hinweis. Die Liste der „harmlosen Substanzen“ umfasst neben Pollen und Tierhaaren auch „Nahrungsmittel“ - und damit die Hauptaller-gene überhaupt, z. B. Kuhmilch 54 und Weizen 55.
Kuhmilch kann für Neugeborene tödlich sein 56. Eine Kuhmilchallergie ist der hauptsächliche Auslöser des plötzlichen Kindstods. Weizen kann Gedeihstörungen hervorrufen. Eine Weizenallergie kann dazu führen, dass Leute keine Darmzotten mehr haben – ohne jemals über Verdauungsprobleme zu klagen 55. Das Kasein der Kuhmilch und das Gluten des Weizen sind also keine „normalerweise harmlose“ Substanzen, sondern gefährliche Proteine, die das Immunsystem normalerweise als solche erkennt.
Die eigentlichen Allergene stammen aus der Kuhmilch, aus Weizen, Roggen, Gerste, Soja und Mais 57. Die ganze Liste kann bei Kindern Immunreaktionen in Form von Allergien hervorrufen. Man hört oft, solche Allergien würden „sich auswachsen“ 58. Schließlich nähmen die Symptome gewöhnlich mit der Zeit ab. Doch nicht alle Symptome verschwinden, und manche verändern sich nur. Kinder, die irgendwann unter einer Allergie leiden, neigen dazu, später auch andere zu entwickeln 59, 60.
Allergene können auch generalisieren (übergreifende Formen annehmen): Zu einer Gräserpollen-Allergie kann eine Birkenpollen-Allergie hinzukommen. Aus einem Heuschnupfen kann schließlich Asthma werden 49.
Kuhmilch, Gluten-Getreide, Soja und Mais: das „sind die wichtigsten Allergene bei Menschen, Hunden und Katzen, weil es die primären Allergene sind, die den Darm schädigen und in der Folge Immun-reaktionen auslösen. Alle anderen Lebensmittelallergene sind sekun-där und ziehen eine Immunreaktion nach sich, während sie den bereits geschädigten Darm passieren. Das ist die anerkannte Patho-physiologie von Lebensmittelallergien der Zöliakie des Erwachsenen-alters, keine Theorie“ (John Symes 57). (Pathophysiologie: vom grch. „pathos“, Leidenschaft; Leiden + „physis“, Natur + „logos“, Wort; Lehre: Lehre von den krankhaften Lebensvorgängen oder solche Vorgänge selbst.)
Die Fehlerhaftigkeit liegt also nicht aufseiten des Immunsystems, sondern aufseiten des „Nutzers“. Eine Allergie ist in erster Linie eine physiologische (gesunde) Reaktion des Immunsystems auf gefährliche Fremdstoffe. Eine ignorierte Allergie ist ein unbeachteter Hilferuf des Immunsystems. Was danach geschieht, sind allergische Notfallreaktionen.
Selbstzerstörung
Die verschiedenen Faktoren des allgemeinen und spezifischen Systems wirken auf vielfältige Weise zusammen. „Betriebsstörungen“ führen zu einer entsprechenden Vielfalt von Fehlfunktionen. Allergische Reaktionen sind deshalb nicht immer scharf von Autoimmunreaktionen zu trennen.
Die Zöliakie (vom grch. „koilia“, Bauch: auch „Glutenunverträglichkeit“) bsw. gilt sowohl als Allergie wie auch Autoimmunkrankheit 55, 59, 60. Der kritische Stoff ist das Gliadin des Weizens. Die Reaktion des darmassoziierten lymphatischen Gewe-bes (GALT) besteht zunächst darin, Antikörper dagegen zu bilden. Es handelt sich um IgA und (das unspezifischere) IgG. Das ist die Allergie.
Gleichzeitig wird das Enzym Gewebstransglutaminase im Bindegewebe des Darms aktiviert, um das Gliadin abzubauen 61. Das Abbauprodukt verteilt sich über die Darmschleimhaut und verursacht großflächige Schäden. In der Folge werden Antikörper (Autoantikörper) gegen die Gewebstransglutaminase gebildet. Mit der Gewebstransglutaminase wird auch körpereigenes Gewebe angegriffen und zerstört. Das ist die Autoimmunkrankheit.
Die Liste der Autoimmunkrankheiten ist lang 62, 63, 64. Man kennt gegenwärtig etwa 60. Es gibt organspezifische Krankheiten, bei denen bestimmte Organe, z. B. der Magen oder der Dünndarm, betroffen sind. Es gibt systemische Erkrankungen, wo bestimmte Gewebe, z. B. Blutgefäße oder Muskeln, in Mitleidenschaft gezogen werden. Und es gibt Misch- oder Übergangsformen, wo bsw. die Schädigung der Muskulatur auf die Gelenke übergreift.
Organspezifische Autoimmunkrankheiten
- Zu den Autoimmunerkrankungen des Verdauungstrakts gehört die chronische Gastritis, Typ A (vom grch. „gaster“, Magen + „-itis“, Wortbildungselement mit der Bedeutung „Entzündung“; auch „Magen-entzündung“ oder „Magenschleimhautentzündung“). Magendruck, Magen-schmerzen und Sodbrennen sind die häufigsten Symptome.
- Eine weitere Autoimmunerkrankung des Verdauungstrakts ist die Zöliakie. Sie betrifft primär den Dünndarm (siehe oben).
- Morbus Crohn (lat. „morbus“, Krankheit; Crohn: einer ihrer Erstbeschreiber) befällt in erster Linie den Dünndarm und den Dickdarm, kann aber auch im gesamten Verdauungstrakt, von der Mundhöhle bis zum After, auftreten.
- Im Falle des Diabetes mellitus, Typ 1 (Diabetes: grch. Harnruhr, Harndurchfluss; mellitus: lat. süß; auch „Zuckerkrankheit“; Diabetes mellitus, Typ 1: auch „Kinder-Diabetes“) werden bestimmte Zellen der Bauchspeicheldrüse – sie werden zum sogenannten „Inselorgan“ zusam-mengefasst – zerstört 98. Das Inselorgan produziert das (nach ihm benannte) Hormon Insulin, das die Aufgabe hat, die im Blut schwimmende Glucose in die Zellen zu schleusen.
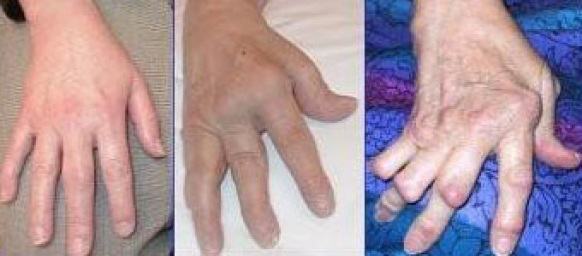
- Unter den „Krankheiten des rheumatischen Formenkreises“, kurz Rheuma (grch. „rheuma“, das Fließen), versteht man Beschwerden des Stütz- und Bewegungsapparats, die mit „fließenden“, ziehenden oder reißenden Schmerzen einhergehen 65. Die häufigste autoimmunbedingte Form ist die rheumatoide Arthritis (-oid: vom grch. „-eides“, -förmig, -artig; Arthritis: vom grch. „arthron“, Glied, Gelenk + „-itis“), auch chronische Polyarthritis (grch. „polys“, viel, vielfältig). Besonders die Innenhäute der Gelenke sind betroffen. Es kommt zu chronischen Entzündungen und als Spätfolgen zu Fehlstellungen der Gelenke (siehe Abbildung 10).
Abb. 10: Polyarthritis, verschiedene Stadien.
Systemische Autoimmunkrankheiten
- Die Multiple Sklerose (multipel: vom lat. „muliplex“, vielfältig, vielfach: wiederholt oder an vielen Stellen im Körper auftretend; Sklerose: vom grch. „skleros“, hart, spröde + -ose, Wortendung mit der Bedeutung „Krankheit“: krankhafte Verhärtung von Geweben oder Organen) ist eine Erkrankung des Nervensystems. Letzteres arbeitet mit elektrischen Strömen, die die Zellmembran der Nervenfaser entlangfließen, um bsw. am Ende der Bahn einen Muskel zu kontrahieren 66. Die Nervenfaser weist eine Ummantlung auf, so dass sie gegen ihre Umgebung und andere Nervenfasern isoliert ist: die Myelin-Scheide (Myelin: eine Mischung aus Fetten und Eiweißen; so benannt von ihrem Entdecker, Rudolf Virchow, nach dem grch. „myelos“, Mark) 67, 68. Je dicker die Myelin-Scheide, desto höher die Leitungsgeschwindigkeit. Die höchste Leitungsgeschwindigkeit haben motorische Nervenfasern (motorisch: vom lat. „motor“, Beweger; zu „movere“, bewegen: die Bewegung betreffend) des peripheren Nervensystems (peripher: vom grch. „peripheres“, sich herumbewegend: am Rand liegend; peripheres Nervensystem: das Nervensystem außerhalb des zentralen Nervensystems: außerhalb von Gehirn und Rückenmark). Im peripheren Nervensystem sind Nervenfasern samt Myelin-Scheide und Bindegewebehülle zu Nervenfaserbündeln oder Nerven zusammengefasst. Im Falle der Multiplen Sklerose wird die Myelin-Hülle der peripheren motorischen Nerven zerstört. Es kommt zu Leckströmen (Stromverlusten) und damit Bewegungsstörungen, da der Strom nicht mehr vollständig oder oder gar nicht mehr an der Muskelendplatte des Muskels ankommt. Das Bild der geschädigten Nerven war namensstiftend für die Erkrankung.
- Eine umfassende, sich mit den rheumatischen Erkrankungen überlappende Gruppe der systemischen Autoimmunerkrankungen sind die Kollagenosen (Kollagen + „-ose“) 69. Kollagen (wie „Gluten“; vom grch. „kolla“, Leim) ist das häufigste Protein des menschlichen Körpers 70. Es besteht aus langen Peptid-Ketten, die sich zu Fibrillen (vom lat. „fibrilla“, Verkleinerungsform von „fiber“, Faser: Fäserchen) und Fasern zusammenschließen. Solche Fasern haben eine enorme Zugfestigkeit und sind kaum dehnbar. Kollagen ist ein Strukturprotein und als solches wesentlicher Bestandteil des Bindegewebes. (Kollagen wurde früher als Knochenleim verwendet und ist nach wie vor Hauptbestandteil von Gelatine, die gewöhnlich aus Schlachtabfällen hergestellt wird.) Unter dem Begriff Bindegewebe werden verschiedene Gewebetypen zusammengefasst, denen gemeinsam ist, dass sie reich an Zwischen-zellsubstanz sind und aus relativ wenigen, großen Zellen bestehen 71. Die Bezeichnung ist eigentlich wenig treffend, da die Funktionen des Bindegewebes weit mehr umfassen als Strukturen zu verbinden oder einzubinden. Das Bindegewebe hält die Form von Körper und Organen aufrecht, dient als Schutzhülle und Wasserspeicher und ist Schauplatz von Immunreaktionen.
Lockeres Bindegewebe findet sich als Füllung von Freiräumen und bildet das Stroma (grch. Streu, Lager: Grund- und Stützgewebe) von Organen.
Fettgewebe hat wenig Zwischenzellsubstanz und damit auch wenig Kollagen. Es dient der Speicherung von Fett.
Straffes Bindegewebe enthält besonders viel Kollagen-Fasern, entweder geflechtartig verbunden, wie bei Sehnen und Bändern, oder parallel angeordnet, wie bei Organkapseln und der Haut. Eingelagerte elastische Fasern (sie enthalten das Protein Elastin) sorgen für Elastizität.
Retikuläres Bindegewebe (lat. „reticulum“, Verkleinerungsform von „rete“, Netz) kommt ausschließlich im Knochenmark und in den sekundären lymphatischen Organen vor. Es stellt den mobilen Zellen der Immunsystems Aufenthaltsorte zur Verfügung.
Knorpelgewebe hat stützende und formgebende Funktion. Es hält die Atemwege der Luftröhre offen, sorgt in den Gelenken für eine Verminderung von Reibungskräften und gibt dem Ohr oder der Nasenspitze ihre Form.
Knochengewebe besteht aus verkalkter Zwischenzellsubstanz, die von speziellen Zellen auf- und abgebaut wird. Die Matrix besteht zu 1/3 aus Kollagen und zu 2/3 aus kristallinem Material mit den Hauptbestandteilen Calcium und Phosphat. Knochen sind gewöhnlich zunächst als Knorpelmodell angelegt und verknöchern später.
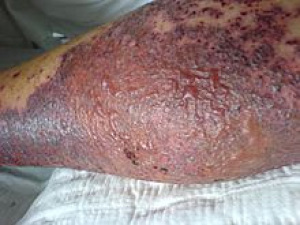
Kollagenosen spielen sich im Bindegewebe ab. Die Immunreaktion richtet sich gegen körpereigene Kollagen-Strukturen. Sie kann praktisch jedes Organ betreffen, aber auch systemisch ausfallen. Letzteres trifft insbesondere auf die Blutgefäße zu 72. Ort des Geschehens ist die bindegewebige äußere Schicht des Gefäßes, mit der es in seiner Umgebung verankert und eingebettet ist Hierher gehören, zumindest teilweise, Vaskulitiden (Singular Vaskulitis: vom lat. „vasculum“, Verkleinerungsform von „vas“, Gefäß + -itis; siehe auch S. 18) 73. Es kommt zu Entzündungen und Schädigungen kleinerer und bisweilen auch größerer Gefäße (sowohl des arteriellen wie auch des venösen Systems), wodurch schließlich auch die versorgten Organe geschädigt oder zerstört werden (siehe Abbildung 11).
Abb. 11: Vaskulitis an der Wade. Endstadium.
Autoimmunkrankheiten werden gewöhnlich definiert als „Krankheiten, deren Ursache eine überschießende Reaktion des Immunsystems gegen körpereigenes Gewebe ist. Irrtümlicherweise erkennt das Immunsystem körpereigenes Gewebe als zu bekämpfende Fremdkörper. Dadurch kommt es zu schweren Entzündungsreaktionen, die zu Schäden an den betroffenen Organen führen“ 62. Das Immunsystem bekommt wie üblich den Schwarzen Peter. Doch was geschieht wirklich?
Reste von Körperzellen oder andere Körpereiweiße schwimmen im Blutstrom durch den Körper 62. T-Zellen und andere Immunzellen identifizieren die körpereigenen Stoffe (anscheinend irrtümlich) als Fremdstoffe und leiten eine Entzündungsreaktion ein. Die T-Zellen aktivieren B-Zellen. Als Plasmazellen sondern sie Antikörper ins Blut ab. Die Antikörper finden ihre Autoantigene (die körpereigenen Antigene, die die Reaktion auslösten) auf MHC-I-Molekülen. Die betreffenden Zellen werden auf diese Weise als Zellen markiert, die zu beseitigen sind. Fresszellen oder CD8-T-Zellen finden sich ein und verrichten ihre Arbeit. So werden Gewebe und Organe geschädigt. Reparaturmechanismen des Körpers springen an, um die Schäden zu beheben. Doch solange der anscheinende Identifizierungsfehler nicht korrigiert ist, wird die Autoimmunreaktion weiterlaufen, bis die Zielstruktur vollständig zerstört ist. Woher also kommt der Identifizierungsfehler? Weshalb wendet sich das Immunsystem gegen den eigenen Körper?
Ein Gift – und wo seine Spur hinführte
Silas W. Mitchell, ein amerikanischer Arzt und Schriftsteller, beschäftigte sich mit tierischen Giften. Es war um 1860, als er herausfand, dass das Gift der Klapperschlange seine Wirkung entfaltet, indem es Erythrozyten im Blut des Opfers agglutiniert (agglutinieren: vom gleichbed. lat. „agglutinare“: verkleben, verklumpen). Die Gefährlichkeit des Gifts beruht darauf, dass es die Erythrozyten an ihrer Arbeit hindert: Sauerstoff von den Lungen zu den Zellen zu transportieren.
Der deutsche Chemiker Hermann Stillmark berichtete 1888 in seiner Dissertation, dass auch pflanzliche Stoffe diese Fähigkeit haben. Er hatte sie u. a. in den Rizinusbohnen, den bohnenartigen Samen des Wunderbaums (wissenschaftlicher Name der Gattung: Ricinus) gefunden 74. Der Wunderbaum ist eine schnellwüchsige Pflanze, die aus dem Nordosten Afrikas und dem Nahen Osten stammt und heute in allen tropischen Zonen verbreitet ist. Die Samenschalen sind äußerst giftig; schon die Schalen von ein paar Samenkörnern sind für den Menschen tödlich. Stillmark vermutete, dass ein Eiweiß für die giftige Wirkung verantwortlich sei. Es wurde später als „Ricin“ (Betonung auf der zweiten Silbe) bekannt.
Stillmarks Doktorvater, Rudolf Kobert, einer der Begründer der Toxikologie (vom grch. „toxikon“, Gift + „logos“, Wort; Lehre: Lehre von den Giften), fand später auch andere Pflanzensamen mit agglutinierender Wirkung. Sie wurden zunächst unter dem Begriff Phytohämagglutinine (vom grch. „phyton“, Pflanze + „haima“, Blut + Agglutinin: Stoff mit agglutinierender Wirkung) zusammengefasst.
1936 gelang es dem amerikanischem Chemiker und späteren Nobelpreisträger James B. Sumner, ein solches Agglutinin aus der Jackbohne (auch „Riesenbohne“) zu isolieren. Aufgrund der Reaktionen, die er bei seinen Untersuchungen beobachtete, gelangte er zu der Annahme, dass es an einem Zucker als Teil eines Proteins (Glykoprotein) auf der Erythrozytenoberfläche bindet.
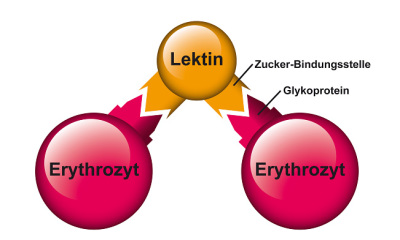
Später entdeckte man Agglutinine, die sich spezifisch an die Erythrozyten der verschiedenen Blutgruppen (A, B, AB und 0) binden. Sie ließen sich verwenden, um den unterschiedlichen Aufbau der Erythrozyten zu entschlüsseln. Das veranlasste William C. Boyd, einen der Pioniere auf diesem Gebiet, 1954 die Bezeichnung Lektine (wie „Gelantine“; vom lat. „legere“, auswählen) dafür vorzuschlagen.
Abb. 12: Agglutinierendes Lektin.
Man kannte bis dahin nur die agglutinierende Wirkung von Lektinen. Folglich nahm man an, dass das Lektin-Molekül mindestens zwei Zucker-Bindungsstellen haben muss – mit denen es zwei oder mehr Erythrozyten miteinander verbindet (Siehe Abbildung 12) 75, 76.
Später fand man jedoch auch Lektine mit anderen Funktionen und Strukturen. So gibt es Lektine mit nur einer Zucker-Bindungsstelle, die zwar mit der Erythrozytenoberfläche reagieren, aber keine Agglutination von Zellen verursachen; und es gibt Lektine mit anderen Bindungsspezifitäten, die sich an andere Zellen wenden.
Eine häufige Funktion solcher Lektine ist der Fraßschutz 77, 78. Sie wirken als natürliche Pestizide, indem sie dem Befall der Pflanze durch Schimmelpilze, Insekten oder Ähnliches entgegenwirken. Tiere lernen, die Pflanze zu meiden oder ihren Verzehr einzuschränken, weil sie ihnen Verdauungsprobleme bereitet. Solche Lektine werden deshalb auch als „Antinährstoffe“ bezeichnet.
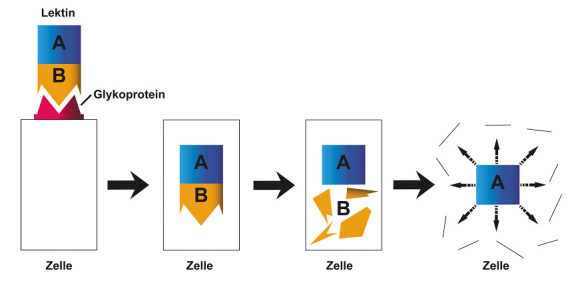
Das Lektin besteht typischerweise aus zwei Untereinheiten. Die Untereinheit B bindet an einen Zucker an der Oberfläche der Zelle. Das Lektin gelangt in die Zelle. Die Untereinheit A spaltet sich von der Untereinheit B ab. Die Untereinheit A zerstört die Zelle (Siehe Abbildung 13).
Abb. 13: Lektin aus der Gruppe der Antinährstoffe.
Lektine dieser Art wurden zunächst in Hülsenfrüchtlern (Bohnen, Erbsen, Erdnüsse) gefunden - in erster Linie in den Samen, aber auch in den Wurzeln (Brennnesseln), Knollen (Kartoffeln), Zwiebeln (Schneeglöckchen) oder der Rinde (Holunder). Ihre Bindungsspezifität umfasst praktisch sämtliche Zucker, die auf tierischen und menschlichen Zellen vorkommen.
„Stellen Sie sich ein Lektin als ein Protein vor, das einen Schlüssel enthält, der in ein bestimmtes Schloss passt. Dieses Schloss ist ein bestimmtes Kohlenhydrat [Zucker]. Alle Lebewesen, Pflanzen und Tiere, Insekten und Schimmelpilze, haben Zellmembranen, die solche Kohlenhydrate enthalten; sie sitzen in der Membran und ragen aus ihr hervor. Wenn ein Lektin mit dem richtigen Schlüssel mit einem dieser ,Schlösser’ an der Darmwand, der Arterie, der Drüse oder dem Organ in Kontakt kommt, öffnet es das ,Schloss’, das heißt, es bricht die Membran auf und beschädigt die Zelle; und möglicherweise setzt es eine Kette von Immun- und Autoimmunreaktionen in Gang, die schließlich zum Zelltod führen“ (Sullivan Krispin) 79, 80.
Tatsächlich enthält jegliche Nahrung Lektine von verschiedener Art und in verschiedenen Mengen. Die meisten stammen von Pflanzen, einige von Bakterien. Die meisten sind harmlos, manche giftig.
Die hauptsächlichen Quellen giftiger Lektine sind allesamt Lebensmittel, die dafür bekannt sind, Allergien hervorzurufen, zum Teil „alte Bekannte“: Milch und Milchprodukte, stark glutenhaltige Getreide (Weizen, Gerste und Roggen), Hülsenfrüchte (Bohnen, Soja und Erdnüsse) und Mais 79, 81. Gartenbohnen können heftige Reaktionen verursachen. In der einschlägigen Literatur wird deshalb dringend davon abgeraten, sie roh essen. Kurzes Kochen zerstört aber das Lektin. Nachtschattengewächse (z. B. Tomaten, Auberginen und Pfeffer) können Problem bereiten. Andere Lektine, z. B. das der Kartoffel, sind hitzebeständiger, aber ungiftig für den Menschen. Milch, Gluten-Getreide, Soja und Mais sind die Hauptquellen.
„Alle komplexen Zellen haben Glykoprotein-Rezeptoren an ihrer Zell-außenwand, an die Dinge wie Antikörper, Viren und Lektine ‚andocken’ können. Wenn ein Lektin an einem dieser Rezeptoren andockt, kann eine von zehn Reaktionen stattfinden, angefangen vom Zelltod bis hin zur Tumorbildung. Irgendwo dazwischen liegen Entzündungsreaktionen …“ (John Symes) 81.
Lektine sind zähe Proteine 79. Sie sind resistent gegen Magensäure und Verdauungsenzyme. Sie binden an der Darmwand und richten Schäden an; und sie leisten auf diese Weise ihren Betrag zur Zöliakie, zur Collitis und zum Morbus Crohn. Lektine, die im Blutstrom durch den Körper vagabundieren, können sich an Zellmembrane von Blutgefäßen, Drüsen und Organen heften, Entzündungen verursachen und Zellen schädigen. Löcher in der Darmwand ermöglichen es auch anderen Proteinen (z. B. Gluten und Kasein), unverdaut ins Blut zu gelangen und allergische Reaktionen auszulösen.
Entzündungen gehen gewöhnlich mit Antigen-Antikörper-Reaktionen einher. Und „diese Antigen-Antikörper-Reaktion könnte der Schlüssel zu vielen, wenn nicht den meisten Autoimmunkrankheiten sein“, meint Krispin, „und möglicherweise sollten wir viele degenerative Krankheiten [Rückbildungen und Verfall von Geweben und Organen] als Autoimmunkrankheiten betrachten“ 79.
Ein Hinweis
Die grundlegende Funktion von Lektinen ist die Erkennung - zu welchem Zweck auch immer 78. Lektine machen es möglich, dass Zellen zueinander finden.
Bestimmte Bakterien können sich nur mit Hilfe von Lektinen an bestimmte Pflanzenwurzeln heften. Erst damit wird die Symbiose zwischen Wurzelknöllchenbakterien und Hülsenfrüchtlern möglich; und nur deshalb gibt es im Garten Bohnen.
Ein ähnlicher Mechanismus ist an der Befruchtung der menschlichen Eizelle beteiligt 80. Die Samenzelle schlängelt sich auf ihrem Weg durch den Eileiter ungehindert an allen möglichen Zellen vorbei. Dann trifft sie auf die Eizelle, und sie hängt fest. Das Lektin am Kopf der Samenzelle hat sein Gegenstück auf der Oberfläche der Eizelle „erkannt“ und einrasten lassen; und nur deshalb kann neues Leben aus einer Ei- und einer Samenzelle entstehen.
„Dass in der Zellwand Glycoproteine sitzen, war altbekannt, aber warum sie dort sitzen, das wusste kein Mensch“, meinte Friedrich Gramer vom Max-Planck-Institut für Experimentelle Medizin, Göttingen zum Ausgangspunkt seiner Forschungen, mit denen er schließlich schließlich herausfand, was einen Körper – auf der biochemischen Ebene - überhaupt zusammenhält.
Verschiedene Zellen weisen sowohl die gleichen Lektine als auch die gleichen dazu passenden Zuckereiweiße an ihrer Zellmembran auf, so dass sie sich auf diese Weise zusammenschließen können. Die Lektin-Zuckereiweiß-Paare sind jedoch von Gewebe zu Gewebe unterschiedlich, sodass sich Nervenzellen mit Nervenzellen, Muskelzellen mit Muskelzelle, Leberzellen mit Leberzellen usw. verbinden und die spezifischen Gewebe, Drüsen und Organe des Körpers aufbauen.
Aus den obigen Erkenntnissen lässt sich unschwer schließen, dass man mit der genetischen Veränderung von Pflanzen Probleme schaffen würde oder wird, die kaum mehr in den Griff zu bekommen sind 79. Durch die „Korrekturen der Evolution“ werden natürlich auch die Lektin-Bestückungen der Pflanzenzellen verändert – und damit ihre Verträglichkeit 79.
Genug ist genug
Auch das Immunsystem selbst kann krank werden. Es kann den ständigen Be- und Überlastungen nur innerhalb biologischer Grenzen standhalten. Vergrößerte Mandeln oder Lymphknoten sind zunächst nur Ausdruck einer Abwehrtätigkeit. Sollte sich der Zustand jedoch chronifizieren, hätten wir es irgendwann mit einem Lymphom zu tun (Lymphom: lymphatisches Gewebe + „-om“, Wortendung mit der Bedeutung „Schwellung, Geschwulst oder Erkrankung, die mit Geschwülsten einhergeht“: Sammelbegriff für Schwellungen und Geschwülste von lymphatischen Geweben und Organen; die einzelne Geschwulst wird „Tumor“ genannt [das lat. Wort für die Geschwulst]) 82.
Es gibt benigne Lymphome (benigne: vom lat. „benignus“, gutmütig, gutartig: harmlos); und es gibt maligne Lymphome (maligne: vom lat. „malignus“, schlecht; bösartig: gefährlich). Kein Lymphom ist – nebenbei gesagt - „gutartig“ oder „bösartig“; es ist, wozu es gemacht worden ist. Die meisten sind „harmlos“, manche „gefährlich“.
Das benigne Lymphom kann durch eine harmlose Erkrankung, wie eine Erkältung oder Zahnprobleme, bedingt sein. Es kann auch Ausdruck einer ernsthafteren Infektion, wie bsw. einer Borreliose infolge eines Zeckenstichs sein (die Borreliose ist eine Infektion mit der Borrelie, einem Bakterium, deren Name uns an den französischen Bakteriologen Amédée Borrel erinnern soll). Wie auch immer, das benigne Lymphom klingt gewöhnlich mit der begleitenden Entzündung ab.
Maligne Lymphome sind Krebserkrankungen 82-86. Sie entstehen, wie jeder Krebs, aus einer einzelnen genetisch veränderten Zelle, „die aufgrund der Mutation [Veränderung] einen Wachstumsvorteil gegenüber den umgebenden ,normalen’ Zellen besitzt“ 85. Der maligne Tumor ist auf eine einzelne Mutterzelle zurückzuführen.
Während gesundes Gewebe aus reifen, differenzierten und organtypischen Zellen besteht, sind die Zellen des malignen Tumorgewebes mehr oder weniger stark entdifferenziert 86. Sie können bei zunehmender Entdifferenzierung immer weniger ihrem Ursprungsorgan zugeordnet werden. Bei völliger Entdifferenzierung besteht keinerlei Ähnlichkeit mehr mit den Zellen des Ausgangsgewebes. Der Entdifferenzierungsgrad entspricht dem Grad der Gefährlichkeit („Bösartigkeit“) des Tumors.
Da sich Krebszellen der Wachstumskontrolle entziehen, wachsen maligne Tumore raumfordernd, chaotisch und invasiv (vom lat. „invadere“, eindringen). Sie wachsen in umliegende Organe ein und zerstören sie. (Auch benigne Tumore fordern Raum, doch sie verdrängen anderes Gewebe eher, als es zu zerstören.) Sie bilden in der Regel auch „Metastasen“ (vom grch. „metastasis“, Umstellung, Wanderung): Tochtergeschwüre, die an entfernten Stellen des Körpers auftreten können.
Der „Wachstumsvorteil“ der Krebszelle, verbunden mit ihrer Entdifferenzierung, weist im übrigen darauf hin, dass sich die Zelle nicht aus „Bösartigkeit“ darauf verlegt hat, den Körper zu zerstören. Es wäre im übrigen auch auffallend „dumm“, denn es ist ja der Körper, dem sie selbst angehört. Die Veränderung der Zelle scheint vielmehr Teil einer Ultima Ratio des Organismus, um einer Nicht-Überlebenssituation zu entkommen 87.
Maligne Lymphome entstehen vor allem in Lymphknoten („Lymph-knotenkrebs“), aber auch Mandeln, Milz und Knochenmark 88. Sie können von da aus auf andere Organe übergreifen. Je nachdem, welche Art von Zellen betroffen ist, gibt es verschiedene Arten von Lymphomen. Traditionell wird unterschieden zwischen Hodgkin-Lymphom (auch „Morbus Hodgkin“, nach dem englischen Arzt Thomas Hodgkin, der die Krankheit 1832 beschrieb) und Non-Hodgkin-Lymphomen (lat. „non“, nicht): alle sonstigen malignen Lymphome.
Das Hodgkin-Lymphom geht von entarteten „monoklonalen“ (von einer einzelnen Mutterzelle abstammenden) B-Zellen in den Keimzentren lymphatischer Gewebe oder Organe aus 88-90. Die entarteten B-Zellen werden als Hodgkin-Zellen bezeichnet. Sie können sich zu mehrkernigen „Sternberg-Reed-Riesenzellen“ zusammenschließen (nach ihren Entdeckern, Carl Sternberg und Dorothy Reed), auch „Hodgkin-Reed-Sternberg-Zellen“ oder kurz HRS-Zellen genannt. Sie machen jedoch nur etwa ein Prozent des Lymphoms aus. Der Rest besteht aus einem Chaos aus anderen Immunzellen und wucherndem Bindegewebe. Das Hodgkin-Lymphom wird anhand der HRS-Zellen von Non-Hodgkin-Lymphomen abgegrenzt.
Typisch für Morbus Hodgkin ist auch eine Mangel an Lymphozyten im Blut – der auf einen erhöhten Verbrauch hindeutet 89, 90. Häufig zeigen sich auch Mängel an Leukozyten überhaupt sowie an Erythrozyten und Thrombozyten.
„Da sich im gesamten Körper lymphatisches Gewebe befindet, kann Morbus Hodgkin überall im Körper entstehen. Die Erkrankung beginnt meist in Lymphknoten der Hals- und Nackenregion und breitet sich über die Lymphknoten im Brustraum auf die Lymphkonten des Bauchraumes und die Milz aus. Über den Blutweg können Hodgkin-Zellen das lymphatische Gewebe auch verlassen und die Leber und andere Organe sowie das Knochenmark befallen. Morbus Hodgkin kann fast alle Organe des Körpers befallen. Unbehandelt verläuft die Erkrankung meist tödlich“ 91.
Die Non-Hodgkin-Lymphome (NHL) kommen in vielfältiger Ausprägung vor 92-94. Sie gehen wie Morbus Hodgkin von entarteten Lymphozyten aus und haben die gleichen Entstehungsorte und Ausbreitungswege. Im Unterschied zu letzterem aber können die Ursprünge sowohl in B-Zellen (bei 80 % der Fälle) wie auch T-Zellen (20 % der Fälle) liegen. Neben den lymphatischen Organen kann auch lymphatisches Gewebe der Haut betroffen sein 88. Der Verlauf geht von Hautausschlägen aus und führt über bräunliche Plaques zu wulstigen Tumoren.
„Grundsätzlich lässt sich sagen, dass einem NHL immer die ungehemmte Teilung von Lymphozyten bei gleichzeitigem Ausbleiben der Apoptose [programmierter Zelltod] der überzähligen Zellen zugrundeliegt. Die Folge ist, dass die Masse und Zahl der entsprechenden Lymphozyten immer mehr zunimmt und somit andere Zellen verdrängt“ 92.
Das Lymphom ist umso weniger maligne, je reifer die entarteten Zellen sind. Hochmaligne Lymphome bestehen aus überwiegend unreifen Zellen (Vorläuferzellen). Es kann zur massiven Ausschwemmung ins Blut kommen – was den Übergang zur Leukämie (siehe unten) ausmacht. „Die Grenze zwischen Lymphomen (Erkrankungen vorwiegend im Lymphknoten oder anderen lymphatischen Organen) und Leukämien (massive Ausschwemmungen der Zellen ins Blut) ist fließend und willkürlich“ 94.
Bei der Leukämie (vom grch. „leukos“, weiß + „haima“, Blut; auch „Blutkrebs“) kommt es zu einer starken (quasi hektischen) Vermehrung von Leukozyten, insbesondere jedoch ihrer funktionsuntüchtigen Vorstufen 95. In der Folge wird die Produktion aller anderen Blutzellen eingestellt. Es entsteht „weißes Blut“, wie Virchow das Phänomen nannte, als er ihm 1845 auf die Spur kam.
Leukämie ist die häufigste Krebsart bei Kindern und Jugendlichen 83. Die Erkrankungsrate nimmt ab dem 30. Lebensjahr kontinuierlich zu 96. Akute Formen der Leukämie sind lebensbedrohlich und führen innerhalb weniger Wochen oder Monate zum Tod. Chronische Formen der Leukämie sind weniger gefährlich und werden am häufigsten als „Altersleukämie“ diagnostiziert.
„Lösungen“
„Die meisten Allergien werden mit Medikamenten behandelt, die das Auftreten von allergischen Symptomen mildern oder verhindern, aber keine Heilung von der allergischen Erkrankung bewirken können“ 49. Darreichungsformen sind Tabletten, Nasensprays, Asthmasprays, Augentropfen, Cremes, Salben und Injektionen. Ähnliches gilt für Autoimmunerkrankungen 62. All dieser Medikamente haben Nebenwirkungen, indem sie in das ohnehin schon geschwächte Immunsystem eingreifen.
„Störungen des Immunsystems kommen bei der Entstehung des Morbus Hodgkin eine bedeutende Rolle zu. Im Rahmen des zunehmenden Einsatzes immunsuppressiver (immununterdrückender) Therapien – beispielsweise nach Transplantation von Organen, Knochenmark oder Blutstammzellen – wird ein vermehrtes Auftreten von Morbus Hodgkin berichtet“ 89.
Grundlage der Behandlung maligner Lymphome sind Chemotherapie und Bestrahlung 89, 92. (Medikamente der Chemotherapie sind Zytostatika [Singular Zytostatikum: Zyto-, Zelle + grch. „statos“, stillstehend: Medikament, das die Entwicklung und Vermehrung schnell wachsender Zellen, wie Krebszellen, hemmt]). Bei Leukämien kommen neben Zytostatika Stammzelleninfusionen sowie Knochenmark- bzw. Stammzellentransplantationen zum Einsatz 95.
Behandlungen dieser Art sind ambivalent. Einerseits kann man damit Menschenleben retten, andererseits sind sie mit weiteren, heftigen Belastungen für den Körper verbunden. Transplantationen sind generell problematisch, da eine der Funktionen des Immunsystems ja darin besteht, körperfremde Zellen (Zellen ohne „Mitgliedsausweis“) zu eliminieren. Man muss daher das Immunsystem stets zusätzlich unterdrücken.
____________________
Das Immunsystem spielt nicht „verrückt“, wenn es seine Arbeit tut. Es gibt keine „Fehlprogrammierung“ des Immunsystems, wenn es körpereigenes Gewebe angreift. Es ist in der Tat ungeschickt, derartige Dinge anzunehmen, solange die Ursachen „bis heute noch nicht genau und im Detail geklärt“ 97 sind. Man nimmt Forschungsergebnisse auf diese Weise vorweg – es sind gewissermaßen Vorurteile.
„Alles hat seinen natürlichen Grund“, sagte der Meister Eder. Mit Vorurteilen wird man nie herausfinden, woher die Krankheiten kommen und was die kranken Leute die ganze Zeit ihrem Immunsystem antun.
□
Literatur
Bircher, Ralph (2010). Geheimarchiv der Ernährungslehre. Rottenburg: Kopp, 13. Aufl.
Hänsel, Rudolf & Sticher, Otto(2010). Pharmakognosie – Phytopharmazie. Heidelberg: Springer, 9. Aufl.
Lippert, Herbert (2000). Lehrbuch Anatomie. München, Jena: Urban & Fischer, 5. Aufl.
Saloga, J., Klimek, L., Buhl, R., Mann, W. & Knop, J. (2006). Allergologie-Handbuch, Grundlagen und klinische Praxis. Stuttgart: Schattauer.
Bilder
Die Abbildungen 1 bis 11 unterliegen der Gemeinfreiheit („public Domain“).
Autor von Abbildung 1: Raffmarra
http://commons.wikimedia.org/w/index.php?title=User:Raffmarra&action=edit&redlink=1
Autor von Abbildung 2 und 3:
Autor von Abbildung 4: NIH
http://commons.wikimedia.org/wiki/User:Kpjas
Autor von Abbildung 5: SEER
http://commons.wikimedia.org/wiki/User:Lennert_B
Autor vom Abbildung 6:
http://commons.wikimedia.org/wiki/User:Arcadian
Autor von Abbildung 7: SEER
http://commons.wikimedia.org/wiki/User:Lennert_B
Autor von Abbildung 8:
http://commons.wikimedia.org/wiki/User:Arcadian
Autor von Abbildung 9: Frank C. Müller
http://commons.wikimedia.org/wiki/User:Frank_C._M%C3%BCller
Autor von Abbildung 10:
http://fr.wikipedia.org/wiki/User:Arnavaz
Autor vom Abbildung 11: Urs Lauper
http://de.wikipedia.org/wiki/User:Urs_Lauper
Autor von Abbildung 12 und 13: Oliver Franke
Web-Links
1 http://de.wikipedia.org/wiki/Hypoallergene_Babynahrung
2 http://de.wikipedia.org/wiki/Z%C3%B6liakie
3 http://de.wikipedia.org/wiki/Verdauungsleukozytose
7 Komplementsystem – Wikipedia
8 MedizInfo®: Leukozyten - Weiße Blutkörperchen
14 Toll-like Receptor – Wikipedia
16 http://de.wikipedia.org/wiki/Zytokin
17 Haupthistokompatibilitätskomplex – Wikipedia
18 Physiologische Funktion der MHC Proteine - Antigenpräsentierung
19 Molekularbiologie des Immunsystems
21 Lymphatisches System – Wikipedia
26 Girolamo Fabrizio – Wikipedia
29 T-Zell-Rezeptor – Wikipedia
32 CD8 - Wikipedia, the free encyclopedia
33 http://www.rms-gs.de/repetitorium/index-Dateien/anatomie/a2122.htm
35 Lymphfollikel - DocCheck Flexikon
37 Sekundäre lymphatische Organe: Lymphfollikel der Schleimhäute
39 Peyer - Plaques – Wikipedia
40 Appendix vermiformis – Wikipedia
41 Darmassoziiertes Immunsystem – Wikipedia
46 Gedächtniszelle – Wikipedia
48 http://de.wikipedia.org/wiki/Cytotoxische_T-Zelle
50 http://www.medizinfo.de/allergie/path/allergietypen.htm
51 http://flexikon.doccheck.com/de/Typ-I-Allergie
52 Asthma bronchiale – Wikipedia
53 http://de.wikipedia.org/wiki/Clemens_von_Pirquet
54 Kuhmilchallergie – Wikipedia
56 http://www.milchlos.de/milos_0313.htm
57 http://dogtorj.com/main-course/epilepsy-and-diet/the-epilepsy-diet-made-simple/
58 http://www.sprechzimmer.ch/sprechzimmer/Fokus/Nahrungsmittel_Allergie_Unvertraeglichkeit
59 http://www.alles-zur-allergologie.de/Allergologie/Artikel/4053/Allergen,Allergie/Milch/
60 Weizenalleregie - die versteckte Allergie
61 Vertriebslizenz Gewebstransglutaminase - Generic Assays GmbH
62 Autoimmunerkrankung – Wikipedia
63 Betroffene Körper- und Organsysteme von Autoimmun-Erkrankungen
64 http://www.medizinfo.de/allergie/path/autoimmunreaktionen.htm
75 Botanik online: Makromoleküle - Lektine
76 Präzipitation (Immunologie) – Wikipedia
81 Food Issues & Epilepsy « DogtorJ.com :: Food Intolerance in Pets & Their People :: Home of The GARD
83 http://www.medizin-fuer-kids.de/kinderklinik/krankheiten/Krebs/start_krebs.htm
86 http://flexikon.doccheck.com/de/Malignit%C3%A4t
87 http://dogtorj.com/main-course/viruses-friend-or-foe/viruses-and-lectins/
88 Malignes Lymphom – Wikipedia
89 Hodgkin-Lymphom – Wikipedia
90 http://flexikon.doccheck.com/de/Leukopenie
91 Erkrankungsverlauf bei Morbus Hodgkin | Krebsgesellschaft
92 Non - Hodgkin - Lymphom – Wikipedia
93 Erkrankungsverlauf beim Non Hodgkin Lymphom | Krebsgesellsch
94 Durchflusszytometrie von Leukämien und Lymphomen
96 http://www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Leukaemien/leukaemien_node.html