Der Stoff, aus dem das Leben kommt
Nr. 3 einer Artikelreihe über die Ernährung
Alles Leben hat sich in den Ozeanen entwickelt oder darin den Ausgangspunkt seiner Entwicklung genommen. Noch heute liegen 90 % des irdischen Lebensraums im Wasser. Alle Lebensformen sind daher wässrige Systeme. Ihre Körper bestehen zum größten Teil aus Wasser. Beim erwachsenen Menschen sind es 75 %, beim Neugeborenen bis zu 90, beim greisen Menschen noch 60.
All das Wasser braucht natürlich einen Gegenpart. Ansonsten gäbe es keine Strukturen, Formen oder Körper. Diesen Gegenpart spielen fettige Stoffe. Die Wand einer jeden Zelle besteht im wesentlichen aus solchen Stoffen. Sie sind wasserunlöslich und bilden so das Grundgerüst des Körpers, von wässrigen Lösungen gefüllt und umflossen. Alle anderen Stoffe – körpereigene Stoffe und Bestandteile der Nahrung - sind darin eingebaut oder unterwegs.
Wasser ist das allgemeine Reagenzmedium des Körpers: der Stoff, in dem alle anderen Stoffe miteinander reagieren. Es ist Grundbestandteil von Blut, Lymphe, Zellflüssigkeit und Zwischenzellflüssigkeit. In diesen und anderen Flüssigkeiten des Körpers werden Bestandteile der Nahrung gespalten, Energie aus Nährstoffen gewonnen und körpereigene Substanzen auf- und abgebaut.
Alle Wahrheit ist einfach
Fareydoon Batmanghelidj (sprich: Faridun Bat-man-gee-lidsch) stammte aus einer angesehenen iranischen Familie 1. Seine Eltern brachten ihn in einem schottischen Internat unter. Später studierte er in London Medizin. Nach Abschluss seines Studiums arbeitete er als Arzt in der Universitätsklinik.
In den Iran zurückgekehrt, wurde er 1979 von der Revolutionsgarde unter Khomeini verhaftet und zum Tode verurteilt. Er entging jedoch seiner Hinrichtung, da seine Häscher herausfanden, dass er Arzt war, und es vorzogen, seine medizinischen Kenntnisse zu nutzen.
So kam es, dass das Gefängnis zum Labor für ihn wurde. Er behandelte an die 3.000 Patienten, die an Magenbeschwerden litten, allein mit Wasser; und er stellte fest, dass sich auch andere Krankheiten mit Wasser lindern oder heilen ließen. Was er so als Ursache dieser Krankheiten herausgefunden hatte, war chronischer Wassermangel („Dehydration“: vom lat. „de-“, weg, von … weg + grch. „hydor“, Wasser).
Batmanghelidj meinte: „Die Heilmethode habe ich nicht im wissenschaftlichen Labor entdeckt. Die Entdeckung der chronischen Dehydration machte ich im Gefängnis von Evin, wo ich drei Jahre inhaftiert war. Die drei Jahre im Gefängnis habe ich nur durch den Einsatz als Gefängnisarzt überlebt. Da mir keine Medikamente zur Verfügung standen, blieb mir nichts anderes übrig, als die Mitgefangenen mit Wasser zu behandeln. So entdeckte ich die einfachste aller Behandlungsmethoden – Wasser trinken.“ 1
Nach seiner Entlassung flüchtete er in die USA, wo er feststellte, dass nicht nur die Gefangenen von Evin an chronischem Wassermangel litten. Die Leute trinken einfach zu wenig Wasser. Und da Wasser auch eine selbstreinigende Funktion hat, ist das Ergebnis eine schleichende Selbstvergiftung, die Störungen und Krankheiten aller Art nach sich ziehen kann.
Dass Wasser auch als Füllstoff der Zellen dient, zeigt, was der chronische Wassermangel oft im Gesicht hinterlässt. Die Haut wird welk und runzelig. Allmählich zeigen sich charakteristische tiefe Falten. Schon im mittleren Lebensalter kann die Haut leder- oder pergamentartig aussehen.
Batmanghelidj bemerkte auch, dass das Problem durch Kaffee, Tee, zuckerhaltige Limonaden und alkoholische Getränke noch verschärft wird. Sie können die Funktionen des Wassers nicht übernehmen. Tatsächlich entziehen sie dem Körper Wasser: das Wasser nämlich, das er braucht, um sie wieder loszuwerden.
Dass die Leute nicht einfach verdursten, scheint oft darauf zu beruhen, dass im Zellstoffwechsel selbst ständig Wasser produziert wird. Der Körper verwendet vor allem Traubenzucker (Glucose) aus Kohlenhydraten und Fettsäuren aus Fetten, um Energie zu gewinnen. Für Traubenzucker heißt das: Traubenzucker reagiert mit Sauerstoff zu Kohlendioxid und Wasser, wobei Energie freigesetzt wird:
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + Energie
C = Kohlenstoff; neulateinisch (wissenschaftssprachlich) „Carbonium“
H = Wasserstoff; neulat. „Hydrogenium“; eigentlich „Wasserbildner“
O = Sauerstoff; neulat. „Oxygenium“; eigentlich „Säurebildner“
C6H12O6 = Traubenzucker (ein Molekül, bestehend aus 6 Atomen Kohlenstoff, 12 Atomen Wasserstoff und 6 Atomen Sauerstoff)
O2 = molekularer Sauerstoff (zwei Atome bilden jeweils ein Molekül)
CO2 = Kohlen(stoff)dioxid
H2O = Wasser
Wir nennen dieses Wasser auch Stoffwechselwasser oder Oxidationswasser (weil es aus einer Reaktion mit Sauerstoff entsteht). Es spielt eine wichtige Rolle bei der Wasserversorgung von Wüstentieren. Im Körper eines erwachsenen Men-schen fällt etwa ein Viertelliter davon täglich an.
Batmanghelidjs Botschaft ist, genug Wasser zu trinken. Und sicherlich ist es besser, genug von irgendeinem Wasser zu trinken – solange es nicht verschmutzt oder vergiftet ist -, als auszutrocknen; und genug sind etwa zwei Liter am Tag. Die Folgen chronischen Wassermangels lassen sich damit zum Teil auch wieder rückgängig machen. Dass Batmanghelidj nichts von Vincent und dessen Forschungstradition wusste (siehe unten), tut seiner Botschaft keinen Abbruch.
Grundlegende Aspekte
Der französische Wasserbau-Ingenieur Louis-Claude Vincent hatte unter weniger dramatischen Umständen zu arbeiten, als er zwischen 1950 und 1974 die Qualität des französischen Trinkwassers untersuchte 2, 3.
Sein wichtigster Befund ist der Zusammenhang zwischen der Gesundheit der Bevölkerung und dem Mineralstoffgehalt ihres Trinkwassers. Er stellte fest, dass die Sterblichkeitsrate in Städten mit mineralstoffarmem Trinkwassers viel geringer ist als in Städten, deren Trinkwasser eine Menge Mineralstoffe enthält. Grenoble bsw. hat relativ reines Wasser – und eine relativ geringe Sterblich-keitsrate. Orte an der Côte d'Azur haben sehr kalkhaltiges Wasser – und eine um ein Drittel höhere Sterblichkeitsrate. Ähnliches fand er hinsichtlich Krebs- und Infarkthäufigkeiten.
Vincent verwendete drei Hauptkriterien, um die Qualität von Wasser zu beurteilen:
1. elektrische Leitfähigkeit
2. pH-Wert
3. Redoxpotential 4
1. Elektrische Leitfähigkeit
Die elektrische Leitfähigkeit ist das primäre Kriterium. Der pH-Wert und das Redoxpotential stehen nicht direkt mit der elektrischen Leitfähigkeit im Zusammenhang.
Nun, was bedeutet elektrische Leitfähigkeit? Sie entspricht der Summe aller leitfähigen Inhaltsstoffe, sprich gelöster Salze, des Wassers. Zu viel davon belastet den Körper – was heute aber bei Leitungswasser und gängigen Mineral-wässern meist der Fall ist.
Steine
Mineralien sind Teil der Erdkruste: das Gestein unter oder in dem von Mikroorganismen gebildeten Boden. Es handelt sich um erstarrtes Magma des Erdmantels oder um Ablagerungen: Staub, den der Wind herangetragen hat, Geröll, das Flüsse bergab transportiert haben, oder Ausfällungen früherer Meere, die Schichten von Steinsalz, darunter von Gips und darunter von Kalk zurückgelassen haben 5, 6. Wasser, das im Boden versickert, um irgendwo wieder als Quelle aufzutauchen, kann auf seinem Weg Teile dieses Gesteins herauslösen.
Tiefengestein ist hart und wenig löslich. Es ist das erstarrte Magma: Granit, Basalt u. ä. Aus Gestein dieser Art fließt weiches Wasser – das dem Körper offensichtlich gut tut.
Das Problem ist das aus Ablagerungen gebildete Oberflächengestein. Es ist „sekundäres Gestein“, indem es sich auf dem erstarrten Magma abgelagert hat. Ein Teil davon besteht aus den Überresten von Organismen: aus den Mineralien der Außenskelette von Muscheln, Wasserschnecken u. ä. Ein Beispiel dafür sind unsere Kalkalpen. Gestein dieser Art ist lockerer zusammengesetzt und leichter löslich. Das ist es, was das Wasser hart macht – und damit belastend für den Körper. Es kommt vielleicht aus einer wunderschönen Gegend, es ist vielleicht frei von aller Verschmutzung. Doch die Geschichte des Planeten hat es schlicht und einfach mit sich gebracht, dass es – zumindest auf Anhieb – nicht sonderlich als Trinkwasser geeignet ist. Das ist die Lektion, die es hier zu lernen gibt.
Wenn man hartes Wasser verdampft, bleiben mehr „harte“ Trockenrückstände übrig: daher die Wortverwendung. Hartes Wasser kommt aus Gegenden, in denen Kalk- und Sandgesteine vorherrschen 7. Es sind diese Inhaltsstoffe des Wassers, die sich im Körper ablagern, sofern sie nicht über die Harnwege ausgeschieden werden können.
Salze
Mineralien sind von der Stoffbindungsart her Salze 8. Manche sind in Wasser löslich, manche nicht. Manche sind für den Körper verwertbar, manche nicht. Die meisten Salze haben zwei Bindungspartner. Beide allein sind instabil; sie brauchen einen Bindungspartner, um zusammen mit ihm einen stabilen Zustand zu erreichen. Letzteres ist eine übliche Eigenschaft von Stoffen. Das Besondere an Salzen ist, dass die Partner sehr unterschiedlich sind, sich gleichwohl ideal ergänzen. Der eine hat oftmals nur eine einzige elektrische Ladung zu viel, der andere eine einzige zu wenig im Atom, um einen stabilen Zustand einzunehmen.
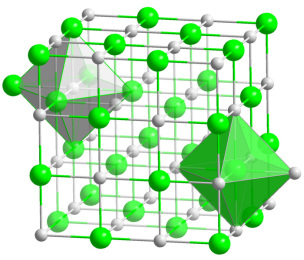
Steinsalz (siehe oben) besteht aus vielen verschiedenen solcher Salze 6, 9. Hauptbestandteil jedoch ist Kochsalz; es schmeckt „salzig“ und ist, was wir gewöhnlich unter „Salz“ verstehen. Es besteht aus den beiden elementaren Stoffen („Elementen“) Natrium und Chlor 10. Das Natrium-Atom hat eine elektrische Ladung zu viel, das Chlor-Atom eine zu wenig. Beide Stoffe haben sich deshalb im Verhältnis 1:1 zusammengefügt – und heißen auch „Natriumchlorid“:
Abb. 1: Kristallgitter von Natriumchlorid. Natrium-Atome (grau) und Chlor-Atome (grün) wechseln sich regelmäßig in jeder Raumrichtung ab. Die achtflächigen Körper zeigen jeweils ein Atom mit seinen sechs nächsten Nachbaratomen.
In seiner ursprünglichen Vielfalt ist Steinsalz eine Wohltat für den Körper, weil es alle möglichen elementaren Stoffe beinhaltet. Es enthält stets zu ca. 97,5 % Natriumchlorid; den entscheidenden Unterschied aber machen die verbleibenden 2,5 % aus. Die ganze Mischung besteht aus Massen- und Spurenelementen, Elementen also, die in größeren oder kleineren Mengen oder auch nur in „Spuren“ vorliegen: Calcium, Kalium, Magnesium, Eisen, Zink, Jod, Fluor u. a.
Isoliertes Kochsalz, die Billigvariante von Speisesalz, besteht nur noch aus Natriumchlorid und ist für den Körper auf die Dauer giftig. Es stellt eine Irritation dar, die Suchtverhalten auslöst. Der Körper erwartet das ganze Spektrum des natürlichen Steinsalzes, doch er bekommt nur einen Teil davon. Deshalb wird er um so hungriger nach Salz, je mehr an isoliertem Kochsalz er erhält. Ein Mensch braucht am Tag nicht mehr als 5 g Salz. So aber nehmen die Leute am Tag bis zu 20 g Kochsalz zu sich, während der Körper nur ca. 5 g über die Nieren ausscheiden kann. Der Rest bildet unansehnliches Wassergewebe und treibt den Blutdruck in die Höhe.
Salze - Steinsalz wie auch alle anderen - bilden Kristalle: dreidimensionale Gitter, in denen die Atome der beteiligten Stoffe regelmäßig angeordnet sind (siehe Abb. 1) 11. Wenn die im Gitter wirkenden Kräfte schwächer sind als die Zugkräfte des Wassers, löst sich der Kristall im Wasser auf. Das gilt für alle Bestandteile von Steinsalz. Und das ist einer der Gründe, weshalb Natrium, Chlor, Calcium, Magnesium usw. im Trink- oder Leitungswasser vorhanden sein können 10.
Die Sache ist nicht ganz so einfach im Falle von Gips - den wir unter der Steinsalzschicht finden und der die Wasserhärte erhöht 12. Hier ist der eine Bindungspartner Calcium: ein Element mit zwei überschüssigen elektrischen Ladungen im Atom. Der andere Bindungspartner ist Sulfat (lat. „sulfur“, Schwefel): im Gegensatz zu Calcium kein Element, sondern bereits eine Verbindung von zwei Elementen, nämlich Schwefel und Sauerstoff 10.
Sulfat ist von der Stoffbindungsart her ein Molekül (vom lat. „moles“, Masse). Das heißt, es besteht aus zwei relativ gleichwertigen Partnern, die stark miteinander verbunden sind und im Salz gemeinsam als ein Stoff auftreten. Dem Molekül fehlen zwei elektrische Ladungen zur Stabilität. Beide Bindungspartner des Gipskristalls haben deshalb wiederum im Verhältnis 1:1 zusammengefunden.
Gips ist, wenn auch nur in geringem Maße, in Wasser löslich. Deshalb kommt gewöhnlich auch Sulfat im Trinkwasser vor.
Kalk hat vom Aufbau her eine gewisse Ähnlichkeit mit Gips 13. Er enthält ebenfalls Calcium, die Rolle des Sulfats spielt jedoch das Carbonat (neulat. „carbonium“, Kohlenstoff: das vom lat. „carbo“, Kohle): eine molekulare Verbindung von Kohlenstoff und Sauerstoff 10, 14. Da er aber weit mehr als Gips im Oberflächengestein vertreten ist, spielt er auch eine weit wichtigere Rolle für die Wasserhärte.
Kalk selbst („Calciumcarbonat“) ist zwar kaum in Wasser löslich, im Boden gelöstes Kohlendioxid ermöglicht jedoch eine Trennung von Calcium und Carbonat. Dasselbe gilt für Magnesium in Calcium-Magnesium-Mischcarbonaten 14, 15.
Calcium und Magnesium sind die hauptsächlichen Härtebildner im Wasser 7. Dazu kommen in Spuren Strontium und Barium (zwei weitere Elemente) 10. Wenn man hartes Wasser erhitzt, rekristallisieren (lat. „re-“, wieder, zurück) die darin gelösten Salze an den Wänden der benützten Gefäße. Calcium- und Magnesiumcarbonate bilden auf diese Weise den Kesselstein (Kalkablagerungen) in Wasserkochern, Töpfen, Wasserleitungen usw 16. Wenn Sie also Ihren Wasserkocher regelmäßig entkalken müssen, ist das Wasser, das Sie darin erhitzen, nicht als Trinkwasser geeignet.
Ladungen
Das Atom (vom grch. „a-“, nicht, un- + „temnein“, schneiden, teilen: das mit chemischen Mitteln „Unteilbare“) besteht aus drei verschiedenen Elementarteilchen. Im Kern haben wir Protonen (vom grch. „proton“, das erste). Sie bilden etwa die Hälfte der Masse des Atoms. Sie üben darüber hinaus eine anziehende Kraft auf bestimmte andere Teilchen aus: die Elektronen (vom grch. „elektron“, Bernstein; schon im antiken Griechenland war bekannt, dass man Bernstein durch Reiben statisch aufladen kann). Elektronen haben kaum Masse, bewegen sich aber sehr schnell um den Kern. Ihre Fliehkraft hat den gleichen Betrag wie die Anziehungskraft der Protonen. Beide Kräfte neutralisieren sich somit gegenseitig und halten das Atom zusammen. Ebenfalls im Kern haben wir Neutronen (vom lat. „neuter“, keiner von beiden). Sie bilden die andere Hälfte der Atommasse.
Die Kräfte der Protonen werden „positive Ladungen“, die Kräfte der Elektronen „negative Ladungen“ genannt. Die Massen der Elementarteilchen sind sehr gering. Das Atom ist zum größten Teil leerer Raum, der durch die entgegengesetzten Ladungen von Protonen und Elektronen aufrechterhalten wird.
Ein Atom im Grundzustand hat stets die gleiche Anzahl von Protonen und Elektronen. Die Anzahl von Neutronen kann variieren. Da sie keine Ladung haben, spielen sie jedoch bei chemischen Reaktionen keine Rolle. Das gewöhnliche Natrium-Atom bsw. hat 11 Protonen, 11 Elektronen und 12 Neutronen. Es ist aufgrund der Anzahl seiner Protonen bzw. Elektronen das 11. Element des Periodensystems der Elemente 10. Das Atom ist nach außen hin elektrisch neutral - da es ja die gleiche Anzahl von Protonen und Elektronen enthält.
Elektronen bewegen sich auf „Bahnen“ oder „Schalen“ um den Atomkern 17, 18. Jede Schale ist mit einer bestimmten Anzahl von Elektronen vollständig 19. Für die erste, dem Kern am nächsten liegende Schale sind das 2, für die zweite Schale 8, für die dritte Schale (zunächst) ebenfalls 8.
Das Natrium-Atom hat 11 Elektronen: auf der ersten Schale 2, auf der zweiten Schale 8 und auf der dritten Schale 1. Chlor hat 17 Elektronen: auf der ersten Schale 2, auf der zweiten Schale 8 und auf der dritten Schale 7. Natrium- und Chlor-Atome reagieren miteinander, indem beide zusammen eine vollständige dritte Schale mit 8 Elektronen bilden. So kommen wir zu Natriumchlorid 20, 21.
Natriumchlorid löst sich sehr gut in Wasser – was uns jede Hausfrau bestätigen kann. Das Elektron, das das Natrium-Atom in die Verbindung eingebracht hat, bleibt dabei jedoch beim Chlor-Atom. Es ist das stärkere von beiden. Dem Natrium-Atom fehlt nun ein Elektron, das Chlor-Atom hat eines zu viel. Da man die Ladung des Elektrons als negativ bezeichnet, betrachtet man das Natrium-Atom nun als positiv und das Chlor-Atom als negativ geladen.
Wenn man das Wasser verdampft, wandern beide Atome wieder zueinander. Deshalb nennt man sie Ionen (grch. „ion“, das Wandernde) 22 . Natrium-Ionen sind positiv geladene Ionen (Na+), Chlor-Ionen negativ geladene Ionen (Cl-). Zweifach positiv geladene Ionen bilden bsw. Magnesium (Mg2+) und Calcium (Ca2+), zweifach negativ geladene bsw. Sulfat (SO42-) und Carbonat (CO32-). Positiv geladene Ionen werden auch als Kationen (grch, „kata“, hinab) 23, negativ geladene Ionen als Anionen (grch, „ana“, hinauf) 24 bezeichnet. Ionen brauchen wir, um irgendeine elektrische Aktivität im Wasser messen zu können.
Messungen
Wasser ist ein schlechter elektrischer Leiter. Tatsächlich leitet reines Wasser fast überhaupt keinen Strom. Das ändert sich jedoch mit dem Gehalt an gelösten Mineralstoffen bzw. Salzen.
Wir können das messen, indem wir eine Spannung an das Wasser anlegen. Das heißt, wir schließen zwei Kabel an die beiden Pole einer Batterie an. Die Kabel haben an ihren freien Enden jeweils eine Elektrode (ein Stück blankes Metall), die wir ins Wasser eintauchen. Die mit dem Minus-Pol der Batterie verbundene Elektrode ist die Kathode (vom grch. „kata“, hinab + „hodos“, Weg). Das ist die Elektrode, über die dem Wasser Elektronen zugeführt werden 25. Die mit dem Plus-Pol der Batterie verbundene Elektrode ist die Anode (vom grch. „ana“, hinauf + „hodos“). Das ist die Elektrode, die Elektronen aus dem Wasser aufnimmt 26.
Die Kationen, z. B. Na+, Mg2+ oder Ca2+, wandern zur Kathode (deshalb hat man sie so genannt) 25, 26, 27. Sie werden entladen, indem sie ein bzw. zwei Elektronen erhalten. Anionen, z. B. Cl-, SO42- oder CO32-, wandern zur Anode. Sie werden entladen, indem sie ein bzw. zwei Elektronen abgeben. Auf diese Weise wird der Stromkreis geschlossen, und es fließt ein leichter elektrischer Strom durch das Wasser. Deshalb sprechen wir von „elektrischer Leitfähigkeit“.
Die elektrische Leitfähigkeit des Wassers entspricht der Menge der darin gelösten Salze 28. Die Benennung ist eigentlich „Siemens pro Meter“ (s/m) 29. Da die Zahlen damit beim Wasser sehr klein werden, verwendet man im allgemeinen „Mikro-Siemens pro cm“ (μs/cm). 1 μs/cm = 0,000.1 s/m. Die elektrische Leitfähigkeit des Münchner Leitungswassers bsw. beträgt im Mittel 0,046.8 s/m oder 468 μs/cm. Je höher die elektrische Leitfähigkeit, desto härter das Wasser.
Der Kehrwert der elektrischen Leitfähigkeit ist der spezifische Widerstand (der Kehrwert einer Zahl z ist 1/z). Das heißt, je besser ein Stoff den elektrischen Strom leitet, desto geringer ist sein Widerstand, und umgekehrt. Die grundlegende Benennung ist „Ohm mal Meter“ (Ω ∙ m). Der spezifische Widerstand des Münchner Leitungswassers ist also: 1/0,046.8 Ω ∙ m = 21,4 Ω ∙ m oder 2140 Ω ∙ cm. Je höher der spezifische Widerstand, desto weicher (oder „leichter“) das Wasser.
Die elektrische Leitfähigkeit des Wassers in μs/cm, multipliziert mit dem Wert 0,7 ergibt etwa die Gesamtmenge der gelösten Feststoffe in Milligramm pro Liter (mg/L) 30. (Der Wert 0,7 ist ein Erfahrungswert.) Im Falle des Münchner Leitungswassers sind das: 468 ∙ 0,7 ≈ 330 mg/L.
Aus der elektrischen Leitfähigkeit lässt sich auch auf die Anzahl der Teilchen in ppm (für engl. „parts per million“, Teilchen pro Million) schließen 31. „100 ppm“ bedeutet in diesem Fall, dass 100 Ionen pro Million Wasser-Moleküle vorhanden sind.
1 μs/cm entspricht ungefähr 0,5 ppm. Das Münchner Trinkwasser hat also ungefähr: 468 ∙ 0,5 ≈ 230 ppm.
Das sind in etwa die Angaben, die Sie auf den Etiketten gewöhnlicher Mineralwasserflaschen finden. Und das ist es, was Sie wissen müssen, um es zu verstehen.
Besonderheiten
Das Wasser-Molekül (H2O) besteht aus zwei Atomen Wasserstoff und einem Atom Sauerstoff. Die Wasserstoff-Atome haben jeweils nur 1 Elektron. (Wasserstoff ist das 1. Element des Periodensystems der Elemente.) Das Sauerstoff-Atom hat 8 Elektronen: 2 auf der ersten Schale und 6 auf der zweiten Schale. (Sauerstoff ist das 8. Element des Periodensystems.) 2 Atome Wasserstoff und 1 Atom Sauerstoff bilden daher ein vollständiges Molekül. Trotzdem ist es nicht völlig neutral. Und das ist es, was Wasser zu einem ganz besonderen Stoff macht.
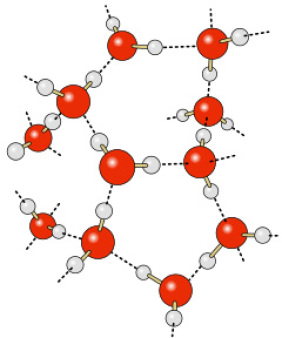
Würden die 3 Atome des Moleküls in einer Reihe liegen – das Sauerstoff-Atom in der Mitte und die beiden Wasserstoff-Atome links und rechts daneben -, wäre es tatsächlich neutral 32. Das Molekül hat jedoch eine gewinkelte Struktur. Es erinnert an die Form eines Bumerangs, mit den beiden Wasserstoff-Atomen an den Enden und dem Sauerstoff-Atom in der Mitte. Das Sauerstoff-Atom zieht die Wasserstoff-Atome ein wenig zur Seite, und so bilden sich Teilladungen aus: zwei positive an den Wasserstoff-Atomen und eine negative an dem Sauerstoff-Atom. Man nennt ein solches Molekül einen Dipol (grch. „di-“, zwei-).
Die positiv geladenen Wasserstoff-Atome und die negativ geladenen Sauerstoff-Atome ziehen sich gegenseitig an. Sie treten durch Wasserstoff/Sauerstoff-Brücken (meist nur „Wasserstoffbrücken“ genannt) in Verbindung 33. Es handelt sich jedoch weniger um chemische Verbindungen als um rasch fluktuierende Wechselwirkungen. Sie lassen mannigfaltige Netze (auch „Cluster“, engl. Anhäufung, Schwarm) entstehen, die innerhalb von Sekundenbruchteilen ihre Verknüpfungen ändern 34, 35.
Abb. 2: Wasserstoff-Brücken. Rot jeweils die Sauerstoff-Atome, grau die Wasserstoff-Atome, gestrichelt die Brückenverbindungen.
Die im Wasser wirkenden Kräfte sind relativ schwach. Sie sind jedoch stark genug, um Wasser zum allgemeinen Lösungsmittel organischen Lebens, im speziellen des menschlichen, zu machen. Es sind diese Kräfte, die Salzkristalle aufbrechen, den Zucker im Kaffee verteilen und die Schmutzpartikel von der Haut lösen. Sie bilden im übrigen auch jene „Oberflächenspannung“ aus, die dafür verantwortlich ist, dass Wasser nass ist: dass es Tropfen bildet, anstatt sich gleichmäßig zu verteilen.
Wasser kann alles in seinen Netzen festhalten, was wasserlöslich ist. Sobald es gesättigt ist (Leitfähigkeit > 160 μs/cm), beginnen sich die überschüssigen Stoffe abzusetzen. Ein Teil dessen, was im Leitungs- oder Trinkwasser gelöst ist, kann sicherlich vom Körper aufgenommen und genutzt werden. Das gilt z. B. für die Bestandteile von Steinsalz. Ein anderer Teil kann möglicherweise ins Blut, nicht aber in die Zellen gelangen. Die Teilchen scheinen einfach nicht vollständig gelöst; und die Zellen können nichts mit geriebenen Steinen anfangen.
Was nicht ausgeschieden werden kann, wird sich irgendwo ablagern müssen. Mögliche Fundstätten sind Grieß und Steine in Galle, Nieren und Harnblase. Zusammen mit anderen Schlacken können sie sich im Laufe der Zeit auch an und in den Wänden der Blutgefäße festsetzen. Der Begriff „Arterienverkalkung“ ist durchaus treffend. Wenn eines dieser Gefäße im Gehirn platzt, bedeutet das einen Schlaganfall. Oft sind es viele kleine Schläge, die das Leben des greisen Menschen allmählich beenden.
Die meiste Härte des Wassers kommt von Calcium- und Magnesium-Carbonaten (Kalk), und deshalb kann die in Europa so weit verbreitete Idee, dass gutes Trinkwasser möglichst viel an „Mineralien“ beinhalten sollte, nur als absurd betrachtet werden – wenngleich sie immer noch die Werbung beherrscht. Sie wird im übrigen auch von der Weltgesundheitsorganisation (WHO) moniert. Allem Anschein nach stammt sie aus einer Zeit, als man die Mineralstoffe gerade für den Körper entdeckt hatte.
Die Frage nach dem Sinn oder Unsinn von Mineralstoffen im Trinkwasser ist eigentlich jedoch von vornherein irrelevant. Trinkwasser hat sicherlich nicht die Aufgabe, den Körper mit Mineralstoffen zu versorgen – ansonsten müsste man es ihm schon kübelweise verabreichen. Wasser hat in diesem Zusammenhang vielmehr eine Transportfunktion. Je leerer seine Netze („Cluster“) sind, desto mehr kann es darin aufnehmen und transportieren. Je mehr bereits darin enthalten ist, desto nutzloser ist es. Ab einem bestimmten Sättigungsgrad wird es selbst zum Problem, weil reineres Wasser notwendig wäre, um aus dem Körper zu schaffen, was das „Mineralwasser“ mitgebracht hat.
Qualitäten
Folgendes ist eine Beurteilung der Wasserqualität nach Vincent 36, 37. Es handelt sich um Ergebnisse einer Studie, die er zwischen 1950 und 1974 im Auftrag der französischen Regierung durchführte.
|
Wirkung auf den Organismus |
ppm |
μs/cm |
Ω ∙ cm |
|
sehr gut entschlackend |
bis 45 |
bis 90 |
über 11.000 |
|
gut entschlackend |
45 |
90 |
11.000 |
|
noch befriedigend |
70 |
140 |
7.140 |
|
keine Wirkung mehr |
100 |
200 |
5.000 |
|
bereits belastend |
150 |
300 |
3.330 |
|
sehr schlecht |
300 |
600 |
1.660 |
|
stark belastend, krank machend |
650 |
1300 |
770 |
Die deutsche Trinkwasserverordnung lässt gegenwärtig einen Grenzwert von bedenklichen 2.500 μs/cm zu 31, 37, 56, 105. Der Wert wurde nach der „Wende“ 1990 zunächst von 280 μs/cm auf 1.000 μs/cm erhöht, im Jahr 2000 auf 2.000 μs/cm und im Jahr 2001 auf 2.790 μs/cm, bevor er 2011 auf 2.500 μs/cm herabgesetzt wurde. So hat man es den Wasserwerken leichter gemacht, eine „zulässige“ Wasserqualität zu erzeugen.
Das Problem mit der Wasserhärte wird durch Säuren verschärft, die mit dem Regen im Boden versickern 7, 13. Bei der Verbrennung von Kohle und Erdöl entstehen Schwefeldioxid sowie Stickoxide. Sie reagieren mit Wasser zu Schwefel- bzw. Salpetersäure. Und letztere nagen an Kalk, Gips und Tonmineralien.
Das eigentliche Übel aber ist der landwirtschaftliche Dünger 37a, 37b. Mineralische Dünger beinhalten in erster Linie Stickstoff, Phosphor und Kalium: die Hauptnährstoffe von Pflanzen.
Stickstoff (N; für neulat. „Nitrogenium“) macht als Gas (N2) volumenmäßig etwa 80 % der irdischen Atmosphäre aus. (Es wäre eigentlich also genügend davon vorhanden.) Im Boden wird er von Bakterien zunächst zu Ammonium (NH4+), dann zu Nitrit (NO2-) und schließlich zu Nitrat (NO3-) umgewandelt. In dieser Form kann er von den Pflanzen aufgenommen werden; und so gelangt er auch in die Nahrungskette. Wiederum andere Bakterien machen aus überflüssigem Nitrat Stickstoff-Gas und schließen so den natürlichen Stickstoff-Kreislauf.
Stickstoff in diesen und anderen Formen wird auch bei der Düngung eingesetzt: als Bestandteil der Gülle ebenso wie von mineralischem Dünger. Die Bodenfauna trägt ihren Teil dazu bei, um ihn den Pflanzen als Nitrat zur Verfügung zu stellen.
Zuviel davon jedoch lässt den Boden versauern, da beim bakteriellen Umbau von Ammonium zu Nitrit/Nitrat eine Menge Säure entsteht (die 2 H+ sind die sauren Wasserstoff-Ionen) 37c:
NH4+ + 2 O2 ↔ NO3- + 2 H+ +H2O
Säuren wirken sich wie besagt aus: sie lösen den Kalk auf. Und da die misshandelten Böden in Abwesenheit von Kalk immer weiter versauern, lässt man ihnen nun Kalkdüngungen zukommen - womit die ganze Reaktion aufrechterhalten wird.
Das Problem mit dem Nitrat, das ins Trinkwasser gelangt, besteht darin, dass es von Bakterien der Darmflora wieder zum gesundheitsbedenklichen Nitrit umgewandelt werden kann. Das bildet möglicherweise Nitrosamine, die zum Teil als krebserregend gelten.
Das Grundwasser enthält natürlicherweise weniger als 10 mg NO3- pro Liter. 20 mg sind für Säuglinge gefährlich. Der gegenwärtige Grenzwert liegt bei 50 mg.
Phosphor in Form von Phosphat ist für Pflanzen ähnlich wichtig wie Nitrat. Phosphat ist chemisch eng mit dem radioaktiven, giftigen Uran verbunden. Ähnliches gilt für das ebenso giftige Cadmium. Beide kommen daher auch in den Mineralien vor, aus denen Phosphatdünger gewonnen wird.
Phosphordüngungen führen daher zu einer Anreicherung des Bodens mit den Schwermetallen Uran und Cadmium; und beide gelangen dadurch auch in die Nahrungskette. Jährlich werden auf dieser Weise ca. 160 Tonnen radioaktives Uran auf deutschen Feldern verstreut.
Ausschwemmungen von Phosphat lassen im Sommer grüne Algenteppiche auf Rinnsalen und Altwassern, an Seeufern und Meeresküsten – bei uns z. B. an der Ostsee – entstehen. Da beim Abbau der Algen- und Pflanzenreste viel Sauerstoff verbraucht wird, kommt es im Tiefenwasser zu Sauerstoffmangel: die gewöhnliche Ursache des Fischsterbens.
Die Düngemittelindustrie und die Verteiler ihrer Produkte haben nicht einmal 150 Jahre für dafür gebraucht.
Lösungen
Man kann natürlich auf das Wasser von mineralstoffarmen, sauberen Quellen zurückgreifen. Doch solche Quellen sind rar. Außerdem sind sie keine Lösung für die Masse der Bevölkerung, die auf das Wasser angewiesen ist, das aus dem Wasserhahn kommt.
Wasser hat gewöhnlich einen niedrigeren Siedepunkt als darin gelöste Stoffe. Das nutzt man bei der Destillation (vom lat. „destillatio“, das Herabträufeln; zu „destillare“, herabträufeln). Man verdampft Wasser und fängt das Kondensat auf, das mehr oder weniger frei von Inhaltsstoffen ist.
Es hat sich jedoch herausgestellt, dass destilliertes Wasser nicht als Trinkwasser taugt 38. Masaru Emoto hat das in jüngerer Zeit sehr eindrucksvoll gezeigt. Er nahm zahllose Wasserproben und fror einzelne Tropfen davon ein. Dabei stellte er fest, dass die Wasserkristalle um so vollkommener und schöner waren, je leichter und sauberer das verwendete Wasser war. Das stark verschmutzte Leitungswasser einiger Großstädte bildete kaum noch oder gar keine Kristalle mehr aus – ebenso wie destilliertes Wasser. Die Polarität und Kraft natürlichen Wassers ist in diesen Fällen verschwunden.
Regenwasser entsteht durch eine Art natürliche Destillation. Wasser verdampft bei natürlichen Temperaturen – in relativ kleinen Mengen pro Einheit Meeresoberfläche, jedoch bei riesigen Gesamtoberflächen. Es kondensiert in kalten Luftschichten der Atmosphäre und sammelt sich zu Wolken. Letztere nehmen ihren Weg, um den Wasserkreislauf der Erde zu schließen.
Regenwasser ist also sehr weiches Wasser. Es ist das „Trinkwasser“ der Natur - und schauen Sie, wie gut es ihr tut! „Wunderliche“ Ärzte gaben es ihren Patienten zu trinken. Leider haben wir mit der Verschmutzung unserer Umwelt auch unser Regenwasser verdorben - Zimmerpflanzen mögen es jedoch immer noch.
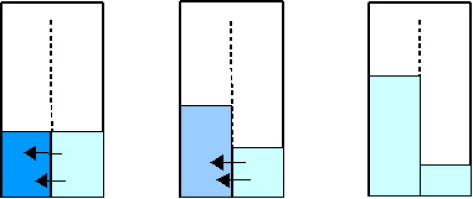
Eine bessere Alternative ist daher die sogenannte „Umkehrosmose“: eine Umkehrung der Osmose (vom grch. „osmos“, Stoß, Schub) 39. Letzteres ist ein Prinzip der Stoffverteilung. Es ist am besten anhand eines Beispiels erklärt: Wir haben zwei Kammern, die durch eine feinporige Scheidewand voneinander getrennt sind (siehe dazu Abbildung 3). Beide Kammern enthalten eine Lösung, d. h. ein Lösungsmittel, bsw. Wasser, plus einen darin gelösten Stoff, bsw. Kochsalz (Natriumchlorid). In der einen Kammer – sagen wir in der linken – ist jedoch zu einem bestimmten Zeitpunkt mehr Natriumchlorid gelöst als in der rechten. Bei der Scheidewand handelt es sich um eine „teildurchlässige“ Membran; sie ist für die kleineren Wasser-Moleküle durchlässig, nicht aber für die größeren Natrium- und Chlor-Ionen. Die osmotische Reaktion besteht nun darin, dass Wasser-Moleküle durch die teildurchlässige Membran von der rechten in die linke Kammer einströmen, bis die Kochsalz-Konzentration, d. h. das Verhältnis von Wasser zu Kochsalz, in beiden Kammern gleich ist.
Abb. 3: Osmose. Wasser strömt von der Kammer geringerer Konzentration in die Kammer höherer Konzentration, bis die Konzentration in beiden gleich ist.
Die Osmose ist ein allgegenwärtiges Prinzip der Biologie. Jede Zelle ist von einer Membran umgeben, die eine Barriere für den ungehinderten Stoffaustausch darstellt. Sie ist für das Wasser durchlässig; andere Stoffe jedoch werden gewöhnlich durch die „elektrischen Schleusen“ von Transportproteinen der Membran in die Zelle hinein oder aus der Zelle heraus transportiert.
Ein drastisches Beispiel für die Wirkungsweise der Osmose ist der Versuch von Schiffbrüchigen, ihren Durst mit Meerwasser zu stillen. Meerwasser hat im Schnitt 25.000 ppm (50.000 μs/cm). Wenn zu viel davon in den Zellzwischenraum gelangt, zieht es alles Wasser aus den Zellen. Das Gewebe schwillt an, der Mensch verdurstet.
Bei der Umkehrosmose wird die Kammer, die mehr an gelösten Teilchen enthält – in der obigen Abbildung ist es die linke – einem Druck ausgesetzt, der höher ist als der Druck, der durch das osmotische Bestreben nach Konzentrationsausgleich entsteht 40. Dadurch werden die Wasser-Moleküle entgegen ihrer natürlichen Bewegungsrichtung in die Kammer gedrängt, in der bereits weniger gelöste Stoffe vorhanden sind. Die Teilchen bleiben in der Membran hängen.
Das Verfahren wird bereits seit langer Zeit eingesetzt, um Meerwasser zu entsalzen. Es ist hat sich auch als brauchbares Verfahren bewährt, um Mineralstoffe und Verunreinigungen aus gewöhnlichem Leitungswasser zu entfernen.
Man kann damit nicht nur etwas für Menschen tun, sondern auch für Tiere und Pflanzen – und auch für alle Haushaltsgeräte, die mit Wasser arbeiten. Großblättrige grüne Pflanzen zeigen weiße Kalkeinlagerungen in den Blättern, wenn man sie mit allzu hartem Leitungswasser gießt; die Einlagerungen verschwinden, wenn man Regenwasser oder entsprechend entkalktes Wasser verwendet. Wasserkocher, in denen ausschließlich Wasser mit einer elektrischen Leitfähigkeit von maximal 25 μs/cm erhitzt wird, brauchen niemals entkalkt zu werden. Waschmaschinen, Geschirrspüler u. ä. halten damit länger.
Geräte für den häuslichen Wasseranschluss sind im Fachhandel erhältlich. Zu beachten wäre allerdings, dass die Geräte ordentlich zertifiziert sind (ein TÜV-Zertifikat haben) und keine Weichmacher aus verwendeten Kunststoffen freisetzen.
2. pH-Wert
(pH: für neulat. „potentia Hydrogenii“, Kraft des Wasserstoffs)
Wenn wir uns mit der elektrischen Leitfähigkeit des Wassers befassen, betrachten wir Wasser-Moleküle als solche, wobei der springende Punkt die Netze sind, die sie bilden. Wenn wir pH-Werte des Wassers untersuchen, beschäftigen wir uns mit einem Teil des Wasserstoff-Atoms: seinem Proton.
Das Wechselspiel
Reines Wasser beinhaltet keinerlei gelöste Stoffe. Von daher dürfte es eigentlich auch keinerlei elektrische Leitfähigkeit aufweisen. Das ist aber nicht der Fall. Es sind immer noch 0,055 μs/cm – was enorme Auswirkungen hat.
Der Grund dafür ist, dass sich vereinzelt Wasserstoff-Ionen aus Wasser-Molekülen (H2O) lösen und anderen Wasser-Molekülen anschließen 41. Das Wasserstoff-Atom besteht gewöhnlich aus 1 Proton und 1 Elektron. Wenn es das Molekül wechselt, bleibt sein Elektron zurück. Somit entsteht dort, wo ein Wasserstoff-Ion (H+) verschwindet, ein OH--Ion, wo es ankommt, ein H3O+-Ion. OH--Ionen heißen auch „Hydroxidionen“, kurz Hydroxid 41. H3O+-Ionen heißen auch „Oxoniumionen“, kurz Oxonium 42.
Das gewöhnliche Wasserstoff-Atom hat kein Neutron; es besteht nur aus 1 Proton in seinem Kern und 1 Elektron auf seiner Schale. Das Wasserstoff-Ion (H+) ist deshalb identisch mit einem Wasserstoff-Proton. Das ist der Grund, weshalb das „Wasserstoff-Ion“ und das „Proton“ in der Chemie Synonyme sind: Mit „Protonen“ sind hier „Wasserstoff-Ionen“ gemeint.
Wir nennen diese Reaktion des Wassers Autoprotolyse (vom grch. „autos“, selbst + Proton + grch. „lysis“, das Lösen; zu „lyein“, lösen). Sie geschieht von selbst. Daher Autoprotolyse. Es geht um das Proton der Wasserstoff-Atome. Das Elektron bleibt zurück. Daher Autoprotolyse. Die Protonen lösen sich vereinzelt aus den Wasser-Molekülen. Daher Autoprotolyse.
2 Moleküle H2O reagieren zu OH- und H3O+, und beide Ionen reagieren zu 2 Molekülen H2O. Es ist eine Gleichgewichtsreaktion, die ständig in beide Richtungen abläuft:
H2O + H2O ↔ H3O+ + OH-
Die Autoprotolyse ist die Grundlage für Säuren und Basen: zwei grundlegende Tendenzen des Wassers.
Die beiden Tendenzen
Säuren sind Verbindungen, die über ionenähnlich gebundene Wasserstoff-Atome verfügen 43. In wässriger Lösung geben sie letztere in Form von H+-Ionen ab. Auf diese Weise entstehen weitere H3O+-Ionen (Oxonium).
Säuren neigen in unterschiedlichem Maße dazu, H+-Ionen abzugeben. Man spricht von stärkeren Säuren (z. B. Salzsäure) und schwächeren Säuren (z. B. Essigsäure). Die ätzende Wirkung der Säure jedoch beruht allein auf der Bildung von H3O+-Ionen.
Säuren kommen als Fruchtsäure im Obst vor, als Abwehrstoff in Brennesseln. Sie sind Bestandteil von Kalk lösenden Reinigungsmitteln und Kalkentfernern.
Wasser verhält sich bei der Autoprotolyse wie eine Säure: Es gibt H+-Ionen ab und lässt H3O+-Ionen entstehen.
Basen sind die Gegenstücke der Säuren 44. Sie sind in der Lage, in wässrigen Lösungen H+-Ionen aufzunehmen und so weitere OH--Ionen entstehen zu lassen. Basen werden manchmal auch „Laugen“ oder „Alkalien“ genannt (vom arab. „al-qalia“, Pottasche; letzteres wiederum ist ein umgangssprachliches Wort für Kaliumcarbonat: eine Verbindung von Kalium, Wasserstoff und Sauerstoff, die in Wasser gelöst als Base reagiert). Man spricht von „basischen“, „alkalischen“ oder „laugenhaften“ Reaktionen.
Basen, z. B. Haushaltsammoniak oder Seifenlauge, sind Fett lösend und werden zur Herstellung von Reinigungs- und Waschmitteln verwendet. Ihre Wirkung beruht gänzlich auf der Bildung von OH--Ionen.
Basen wie Säuren haben in höheren Konzentrationen ätzende und zerstörerische Auswirkungen auf pflanzliche wie tierische Gewebe. Alles Leben spielt sich im mittleren Bereich ab. Das ist es, worauf es hier ankommt.
Wasser zeigt sich bei der Autoprotolyse auch als Base: Indem es H+-Ionen aufnimmt, sorgt es für OH--Ionen. H2O wird jedoch weder als Säure noch als Base, sondern als neutral betrachtet, da es exakt so viele H3O+-Ionen wie OH--Ionen enthält. Gleiche Zahlen bedeuten aber nicht, dass nichts geschieht.
Alle Körperflüssigkeiten tendieren in eine der beiden Richtungen, die das Wasser vorgibt. Säuren und Basen sind jedoch nicht nur Flüssigkeiten. Als Feststoffe sind sie Bestandteil vieler körperlicher Substanzen: von Eiweißen und Fetten. Die Bausteine der Gene bsw. sind einige Säuren- und Basenmoleküle.
Die Maßeinheit
Atome und Moleküle sind sehr kleine Teilchen. Deshalb braucht man eine besondere Maßeinheit dafür, genannt das Mol (mol) 45-50. Es ist per Definition die Menge an Atomen, die in 12 g Kohlenstoff enthalten ist. Das sind 6,022 ∙ 1023 (anders ausgedrückt 6,022 ∙ 100.000.000.000.000.000.000.000 oder 602 Trilliarden) Teilchen.
Woher die Festlegung? Das Kohlenstoff-Atom hat 6 Protonen und 6 Neutronen im Kern. Kohlenstoff hat daher die „Ordnungszahl“ 6 (und ist das 6. Element des Periodensystems der Elemente) und die „Massenzahl“ 12; und daher wiegt 1 mol Kohlenstoff 12 g. Ein weiteres Beispiel: Das Helium-Atom hat 2 Protonen und 2 Neutronen. Helium hat deshalb die Ordnungszahl 2 (und ist das 2. Element des Periodensystems) und die die Massenzahl 4; und deshalb wiegt 1 mol Helium 4 g.
Mit anderen Worten, die Masse von 1 mol eines Elements ist immer seine Massenzahl in g. Es spielt also keine Rolle, ob wir Kohlenstoff, Helium oder was auch immer nehmen. Der springende Punkt ist, dass 1 mol davon 6,022 ∙ 1023 Atome hat – was sich experimentell bestimmen lässt.
Gewöhnlich jedoch gibt es in einer so großen Menge von Atomen eines Elements immer einige, bei denen die Anzahl der Neutronen von der Anzahl der Protonen abweicht. Die Massenzahl ist also nicht immer exakt das Doppelte der Ordnungszahl; und die Masse von 1 mol der Atome ist nicht immer exakt das Doppelte der Ordnungszahl in g. Das ist der Grund, weshalb man sich bei der Definition des Mol für eine bestimmte Art von Kohlenstoff-Atomen entschieden hat: diejenige nämlich, bei der die Anzahl der Neutronen ausnahmslos mit der Anzahl der Protonen übereinstimmt.
Die Zahl 6,022 ∙ 1023 ist eine Naturkonstante (die nach ihrem Entdecker benannte „Avogadro-Zahl“). Sie lässt sich experimentell bestimmen und wird für Atome, Ionen, Moleküle u. ä. verwendet. 1 mol Helium bsw. hat 6,022 ∙ 1023 Helium-Atome; 1 mol Calcium-Ionen hat 6,022 ∙ 1023 Calcium-Ionen; und 1 mol Wasser hat 6,022 ∙ 1023 Wasser-Moleküle.
Die Skala
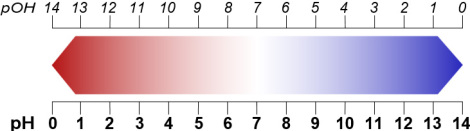
Reines Wasser enthält etwa 10-7 Mol pro Liter (mol/L) an H3O+-Ionen 48, 50. Das sind also 6,022 ∙ 1023 ∙ 10-7 = 6,022 ∙ 1016 ≈ 60 Billiarden Teilchen. Wenn man die Hochzahl der H3O+-Konzentration mit -1 multipliziert, erhält man eine handlichere positive Zahl; und das ist der pH-Wert 7.
Der pH-Wert 6 bedeutet, dass etwa 10-6 mol/L an H3O+-Ionen in der Lösung vorliegen 51, 52. 6,022 ∙ 1023 ∙ 10-6 = 6,022 ∙ 1017 ≈ 600 Billiarden Teilchen.
Der pH-Wert 8 bedeutet, dass etwa 10-8 mol/L an H3O+-Ionen in der Lösung vorhanden sind. 6,022 ∙ 1023 ∙ 10-8 = 6,022 ∙ 1015 ≈ 6 Billiarden Teilchen.
Je niedriger also der pH-Wert, desto höher die H3O+-Konzentration – und damit „die Kraft des Wasserstoffs“. Je höher der pH-Wert, desto weniger Oxonium ist im Wasser enthalten.
Die pH-Skala reicht von 0 bis 14 52. Der Wert 0 ist der Wert einer „Normalsäure“, die 1 mol/L H3O+ und keinerlei OH- enthält – und damit 1 g Wasserstoff pro Liter in Form von H3O+. Der Wert 7 ist der neutrale Wert, an dem sich H3O+- und OH--Ionen die Waage halten. Der Wert 14 ist der Wert einer „Normallauge“, die 1 mol/L OH- und keinerlei H3O+ enthält – und damit 1 g Wasserstoff pro Liter in Form von OH-.
Wässrige Lösungen werden somit wie folgt eingeteilt:
pH < 7: sauer
pH = 7: neutral
pH > 7: basisch
Analog zum pH-Wert lässt sich ein pOH-Wert definieren (pOH: für lat. „potentia“, Kraft + OH-). Dabei gilt:
pH + pOH = 14
oder
pOH = 14 - pH
Abb. 4: pH/pOH-Skala
Eine wässrige Lösung mit dem pH-Wert 6 hat somit den pOH-Wert: 14 – 6 = 8. Es handelt sich um eine saure Lösung. Eine wässrige Lösung mit dem pH-Wert 9 hat den pOH-Wert: 14 – 9 = 5. Es ist eine basische Lösung.
Reines Wasser hat eigentlich also einen pH-Wert von 7. Aufgrund seiner Tendenz, Kohlendioxid aus dem Boden oder der Luft aufzunehmen, wird es gewöhnlich aber einen leicht sauren Wert annehmen. Ansonsten sind abweichende pH-Werte auf die im Wasser gelösten Salze zurückzuführen - wobei der pH-Wert aber nichts über die Menge der gelösten Salze aussagt, da sie ja in die eine oder andere Richtung wirken.
Blutwerte
Wenn in der Literatur von pH-Werten des Körpers die Rede ist, bleibt oft unklar, worauf man sich eigentlich bezieht: auf den Urin? auf das Blut? auf andere Gewebe? 56. Es herrscht auch überraschende Uneinigkeit darüber, was normale und was kritische Werte seien.
Gewöhnlich jedoch gilt als normaler pH-Wert des Bluts 7,4 ± 0,05 57. Der tatsächliche Wert pendelt mit jedem Atemzug innerhalb dieses Bereichs, abhängig von Nahrungsaufnahme, körperlicher Aktivität, Nierenfunktion u. a. 58
Unter den Begriff Säuren-Basen-Haushalt fallen verschiedene Regelmecha-nismen, deren Funktion darin besteht, den pH-Wert des Bluts möglichst nahe an seinem Idealwert zu halten. Das sind im wesentlichen Puffereigenschaften von Blut und Gewebe, der Gasaustausch der Lunge und Ausscheidungsmechanismen der Nieren. Abweichungen vom normalen Bereich führen zur Übersäuerung („Azidose“: vom lat. „acidus“, sauer + -ose, Wortendung mit der Bedeutung „Krankheit“) bzw. Untersäuerung („Alkalose“: alkalisch + -ose) des Bluts.
Das Kohlensäure-Hydrogencarbonat-System ist der wichtigste Blutpuffer zum Auffangen von pH-Schwankungen 59. Die Hauptrollen spielen Kohlensäure (H2CO3) als Säure – die in der Lage ist, Wasserstoff-Ionen (H+) abzugeben – und Hydrogencarbonat (HCO3-) als Base – die in der Lage ist, Wasserstoff-Ionen aufzunehmen.
Wenn das Blut zu alkalisch ist, lösen sich Wasserstoff-Ionen von Kohlensäure-Molekülen. Die Wasserstoff-Ionen lassen den pH-Wert des Bluts sinken. Die KohlensäureMoleküle werden zu Hydrogencarbonat-Ionen:
H2CO3 → H+ + HCO3-
Wenn umgekehrt das Blut zu sauer ist, binden Wasserstoff-Ionen an Hydrogencarbonat-Ionen, wodurch wieder Kohlensäure-Moleküle entstehen. Die Kohlensäure zerfällt zu Kohlendioxid (CO2) und Wasser (H2O). Das Kohlendioxid wird abgeatmet. Der pH-Wert steigt:
H+ + HCO3- → H2CO3 → CO2 + H2O
Es ist ein offenes System, das von Wasser getragen und mit Kohlendioxid betrieben wird. Kohlendioxid fällt massenhaft im Zellstoffwechsel an. Es wird im Wasser zu Kohlensäure umgesetzt. Die Kohlensäure spaltet sich in Wasserstoff- und Hydrogencarbonat-Ionen auf. Beide verbinden sich auf umgekehrtem Wege zu Kohlensäure, die zu Wasser und Kohlendioxid zerfällt, usw. Die Reaktionskette läuft also in beide Richtungen ab:
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3-
Das Kohlensäure-Hydrogencarbonat-System macht den größten Teil des Blutpuffers aus 60. Daneben wirken Hämoglobin (die Sauerstoffrezeption der roten Blutkörperchen) und Phosphat (Wasserstoff-Phosphor-Sauerstoff-Verbindung) als Säurepuffer. Einige Bluteiweiße sind in der Lage, nach Bedarf sowohl Säuren wie auch Basen zu neutralisieren.
Der pH-Wert des Bluts wird des weiteren über eine gesteigerte bzw. verringerte Aktivität der Lunge reguliert. So wird der Atemantrieb stärker, wenn der Kohlendioxid-Gehalt des Bluts steigt bzw. der pH-Wert sinkt, wie bsw. bei körperlicher Arbeit oder Sport (Grund ist natürlich die erhöhte Stoffwechseltätigkeit). Die beschleunigte oder vertiefte Atmung führt kaum zu mehr Sauerstoff im Blut - der Sättigungsgrad bei gewöhnlicher Atmung beträgt bereits 97 %; doch es wird mehr Kohlendioxid abgeatmet. Zur Aufrechterhaltung des stofflichen Gleichgewichts wird Kohlendioxid aus Wasserstoff- und Hydrogencarbonat-Ionen nachgebildet. Die Zahl der Wasserstoff-Ionen nimmt ab; der pH-Wert steigt 61.
Umgekehrt wird der Atemantrieb schwächer, wenn der Kohlendioxid-Gehalt des Bluts sinkt bzw. der pH-Wert steigt, wie im Falle von Antriebslosigkeit, Bettlägerigkeit oder Depressionen. Die verringerte oder verflachte Atmung hält Kohlendioxid im Blut zurück. Es bildet sich vermehrt Kohlensäure, die sich in Wasserstoff- und Hydrogencarbonat-Ionen aufspaltet. Die Zahl der Wasserstoff-Ionen nimmt zu; das Blut wird saurer.
Auch die Nieren tragen ihren Teil dazu bei, den pH-Wert des Bluts im Normalbereich zu halten. Sie tun das, indem sie selektiv Wasserstoff-Ionen ausscheiden und Hydrogencarbonat zurückzuhalten. Die Tätigkeiten von Lunge und Nieren werden zentralnervös, über basale Funktionseinheiten des Gehirns gesteuert.
Das Problem
Die Pufferkapazität des Systems ist begrenzt; und wenn sie überschritten wird, muss auf die Säuren- und Basendepots des Gewebes zurückgegriffen werden. Das Problem dabei sind die Säuren, wie sie im Übermaß in der modernen Industriekost enthalten sind oder daraus im Körper entstehen 58.
Die Basen sind von Haus aus harmlos. Wenn der Körper Säuren braucht, um Basen zu neutralisieren, kann er sie selbst herstellen; und er verfügt über reichliche Reserven im Bindegewebe – wo er ja auch die Säuren unterbringt, die von den Nieren aufgrund von Überlastung nicht ausgeschieden werden können 62. Zu einem Basenüberschuss aus dem, was dem Körper zugeführt wird, kann es deshalb nur bei einer akuten Vergiftung mit Laugen kommen.
Anders sieht es mit den Säuren aus. Mit jedem sauren Wasserstoff-Ion, das der Körper ausscheidet, verschwindet auch ein basisches Hydrogencarbonat-Ion. Basen jedoch kann der Körper nicht selbst bilden. Er muss sie mit der Nahrung aufnehmen. Das größte Basendepot ist die Leber. Sie nimmt im Pfortaderkreislauf Bestandteile der Nahrung aus dem Dünndarm auf, baut sie teilweise um und gibt sie nach Bedarf in den allgemeinen Blutkreislauf ab. Doch wenn die Nahrung kaum noch Basen enthält, gehen auch ihre Vorräte zur Neige.
Atmungsstörungen können das Problem akut werden lassen: Formen der Hyperventilation (vom grch. „hyper“, über, übermäßig + lat. „ventilatio“, das Lüften; zu „ventilare“, lüften, fächern: über den Bedarf gesteigerte Atemtätigkeit; auch „Atemnot“) 61. Die Person ringt nach Luft und hat doch das Gefühl, nicht genug davon zu bekommen. Die Ursachen sind meist seelischer Natur: Angst, Überforderung, Stress u. ä. Bezeichnenderweise ist die Hyperventilation gerade bei Schulkindern verbreitet. Auch körperliche Erkrankungen, wie Infektionskrankheiten, Vergiftungen oder ein Schlaganfall können damit im Zusammenhang stehen. (Hier beginnen „Atemübungen“ tatsächlich Sinn zu machen.)
Durch die gesteigerte Atemtätigkeit wird zu viel Kohlendioxid abgeatmet. Der pH-Wert des Blut steigt. Bei einer Chronifizierung des Zustands kommt es zur Alkalose des Bluts 58. Alkalische Blutwerte disponieren zu Verkrampfungen, Sklerosen (vom grch. „skleros“, hart, spröde: Verhärtungen von untergehenden Geweben und Organen), Thrombosen (vom grch. „thrombos“, Pfropfen: Bildung von Blutgerinseln in den Gefäßen), Arthritismus (vom grch. „arthrits“, Gicht: Neigung zu Gicht, Asthma, Fettsucht u. a.) und Krebs 63.
Wichtiger als der pH-Wert des Bluts werden nun jedoch die alkalischen Reserven, denn die Alkalose führt zu einem chronischen Basenmangel; und wenn die Basendepots leer sind, kommt es zur Katastrophe: zur Azidose 58. Saure Blutwerte gehen mit Vergiftungen, Infektionen, Fieber und Diabetes einher 63.
Es wurde – zumindest in der alternativen Medizin - stets als notwendig erachtet, zwischen der Übersäuerung des Bluts und der Übersäuerung des Gewebes zu unterscheiden 58. Beides lässt sich jedoch nicht klar voneinander abgrenzen. Einerseits enthält auch das Blut Gewebe: die Blutkörperchen, bsw. die roten Blutzellen. Andererseits enthält auch das Gewebe Flüssigkeiten: die Flüssigkeit des Zwischenzellraums und die Zellflüssigkeit. Die Grenze, die eine Unterscheidung sinnvoll macht, ist die Zellmembran. Korrekterweise ist also zwischen intrazellulärer und extrazellulärer Übersäuerung zu differenzieren.
Wenn Wasserstoff-Ionen, z. B. aufgrund eines Kalium-Mangels, aus dem Zwischenzellraum in die Zelle einwandern, ergibt sich in der Zwischenzellflüssigkeit eine Tendenz zur Alkalose, während die Zelle übersäuert ist. Und das ist das Schlimmste, was hier passieren kann.
Übersäuerte Zellen erstarren. Derart veränderte rote Blutzellen werden in ihrer Beweglichkeit beeinträchtigt. Das Blut wird zäher. Durchblutungsstörungen verschlimmern sich. Der eingeschränkte Stoffwechsel produziert noch mehr Säuren. Die lokale Azidose nimmt zu. Das ganze endet möglicherweise in einem Infarkt. Messungen in der Zwischenzellflüssigkeit oder im Urin werden darüber keine Auskunft geben.
Die Alternative
Im gesunden Organismus werden Säuren und Basen geregelt verteilt, wobei das Blut leicht alkalische, das Gewebe geringfügig saure Werte annimmt 64. Außerdem weist jedes Organ und jeder Funktionsbereich sein spezifisches Säuren- oder Basenniveau auf. Die jeweiligen Konzentrationen und Spielräume sind äußerst gering, diesbezügliche Veränderungen aber hoch bedeutsam. Warum? Weil die unterschiedlichen Konzentrationen von Säuren und Basen beiderseits von Zellmembranen oder Membranen innerhalb der Zelle elektrische Potentialgefälle erzeugen, die wiederum die Grundlage für den Austausch ionischer Stoffe bilden, welchen Zwecken auch immer sie dienen.
Die gängige Industriekost zerstört dieses System. Weißes Mehl, raffinierter Zucker, Fleisch, Kaffee und Alkohol: das sind die hauptsächlichen Säurelieferanten. Pflanzen aller Art, aller Geschmacksrichtungen, aller Aromen, aller Farben und aller Konsistenz: das sind die Basenquellen. Das heißt nicht, dass alle Säuren schlecht wären, dass Pflanzen keine Säuren enthielten oder dass manche Pflanzen nicht giftig wären. Es heißt lediglich, dass Pflanzen eigentlich alles enthalten, was Menschen an Nahrung brauchen.
Die Zauberformel
Lawrence Joseph Henderson entwickelte 1906 eine Gleichung, die den Zusammenhang zwischen dem pH-Wert und dem Säuren-Basen-Gleichgewicht in wässrigen Lösungen beschreibt 71. Karl Albert Haselbalch konnte sie experimentell beim menschlichen Blut bestätigen und schrieb sie 1916 wie folgt um. Damit wurde es möglich zu bestimmen, welchen Basenanteil der Blutpuffer braucht und was einen Basenmangel bzw. -überschuss ausmacht. Man spricht von der „Henderson-Haselbalch-Gleichung“ oder einfach „Puffergleichung“:
pH = pKs + log 10 (Stoffmenge Basen/Stoffmenge Säuren)
pH
Der pH-Wert des gesunden Bluts ist etwa 7,4.
pKs
Die Fähigkeit eines Stoffs, Wasser gegenüber als Säure zu reagieren, entspricht seiner Fähigkeit, H+-Ionen an das Wasser abzugeben 68. Stärkere Säuren geben mehr ab, schwächere weniger. Salzsäure bsw. ist eine starke Säure und gibt praktisch seinen gesamten Wasserstoff ab. Apfelsäure kommt als mittelstarke und schwache Säure vor und gibt jeweils nur einen Teil seines Wasserstoffs, im ersten Fall mehr und im zweiten weniger, an das Wasser ab. Jede Säure schafft also eine bestimmte maximale Konzentration von H3O+-Ionen pro Volumeneinheit Wasser.
Bei mittelstarken Säuren beträgt diese Konzentration im Durchschnitt ungefähr 10-3 (= 0,001) mol/L. Wenn wir wieder die Hochzahl nehmen und mit -1 multiplizieren, bekommen wir den Wert 3. Das ist in diesem Fall die Säurekonstante oder der pKs- Wert der Säure (pKs: das „p“ steht wie bei „pH“ für lat. „potentia“, Kraft, das „K“ für „Konstante“ und das kleine „s“ für „Säure).
Das Blut hat einen pKs-Wert von 6,1 58, 70, 71. Das ist der pH-Wert, auf den das Blut der Leiche zurückfällt.
log 10 (Stoffmenge Base/Stoffmenge Säure)
Der log (sprich „Logarithmus“) ist ein Exponent (eine „Hochzahl“). Es ist diejenige Zahl, mit der man eine „Basis“ potenzieren muss, um einen „Numerus“ zu erhalten.
Beispiel
2x = 8 → x = 3
2 ist die Basis. 8 ist der Numerus. Man muss die Basis 2 mit dem Logarithmus 3 potenzieren, um den Numerus 8 zu erhalten.
Probe: 23 = 2 . 2 . 2 = 8
Man schreibt: log 2 (8) = 3
Man spricht: „Der Logarithmus von 8 zur Basis 2 ist gleich 3.“
Beispiel
10x = 10.000 → x = 4
10 ist die Basis. 10.000 ist der Numerus. Man muss die Basis 10 mit dem Logarithmus 4 potenzieren, um den Numerus 10.000 zu erhalten.
Probe: 104 = 10 . 10 . 10 . 10 = 10.000
Man schreibt: log 10 (10.000) = 4
Man spricht: „Der Logarithmus von 10.000 zur Basis 10 ist gleich 4.“
Grundsätzlich steht es einem frei, welche Basis man wählt. In einem Zehnersystem ist es natürlich praktisch, mit dem log 10 („Zehner-Logarithmus“) zu rechnen. Man verwendet ihn oft in der Chemie. Die winzig kleinen Teilchen kommen meistens in riesigen Mengen oder winzigen Massen vor. Und es ist viel leichter, bsw. mit der Zahl 12 zu arbeiten als mit der Zahl 1.000.000.000.000 (= 1012) oder mit der Zahl -12 als mit der Zahl 0,000.000.000.001 (= 10-12). Und natürlich haben wir bei den Herleitung des pH-Werts bereits mit Zehner-Logarithmen gerechnet.
Für den vorliegenden Zweck müssen wir aber nach dem Numerus fragen. Der Numerus ist die Zahl, die man erhält, wenn man die Basis mit dem Logarithmus potenziert.
Beispiel
x = 104 → x = 10.000
10 ist die Basis. 4 ist der Logarithmus. Wir brauchen den Numerus 10.000, um den Logarithmus 4 zur Basis 10 zu erhalten.
Probe: 10.000 = 104
In der obigen Puffergleichung sind der pH-Wert (7,4) und die Säurekonstante (6,1) gegeben. Daraus folgt der Pufferwert (7,4 – 6,1 = 3,1). Sämtliche Werte sind Logarithmen. Wir suchen also nicht den Logarithmus, sondern den Numerus für den Pufferwert. Wir wollen wissen, welches Verhältnis von Basen zu Säuren wir brauchen, um den Zehner-Logarithmus 3,1 erhalten.
Der vorliegende Fall
x = 101,3 → x = 20
Die Lösung ist hier nicht ganz so einfach. Für solche Fälle haben wir jedoch eine „Logarithmen-Tafel“: eine tabellarische Darstellung von Logarithmen/Numeri (der Taschenrechner ist unanschaulicher). Ich habe für Sie darin nachschlagen und gesehen: Man muss den Numerus 20 verwenden, um den Logarithmus 1,3 zur Basis 10 zu erhalten.
Probe: 20 = 101,3 (wiederum aus der Logarithmen-Tafel)
Wir schreiben: log 10 (20) = 1,3
Wir sagen: „Der Logarithmus von 20 zur Basis 10 ist gleich 1,3.“ Oder: „1,3 ist der (Zehner-)Logarithmus von 20.“
Das Ergebnis
Wir erhalten den Wert 1,3 für den Blutpuffer, wenn das Verhältnis von Basen zu Säuren im Blut 20 : 1 (= 20) beträgt. Eine kleinere Verhältniszahl bedeutet einen Basenmangel, eine größere einen Basenüberschuss.
Sanfte Säuren
Der pKs-Wert ermöglicht es einem nicht nur, Säuren miteinander zu vergleichen, sondern auch pH-Werte von Verdünnungen oder Gemischen zu berechnen.
Apfelsäure z. B., in Wasser gelöst, schafft je nach Variante maximal 10-3,5 oder 10-5,1 mol/L Wasserstoff-Ionen 65. Die beiden Varianten der Apfelsäure haben also einen pKs- Wert von 3,5 bzw. 5,1.
Wasser hat natürlich einen Verdünnungseffekt 69. Da reines Wasser etwa den pH-Wert 7 hat, nähert sich der pH-Wert der Säure, von ihrem pKs-Wert ausgehend, mit zunehmender Verdünnung diesem Wert an. So erhält man aus 0,02 L reiner Apfelsäure mit dem pKs-Wert 5,1, wenn man sie auf 1 L streckt, eine Lösung mit dem pH-Wert 6,8: eine 2- %-ige Lösung, wie sie in reifen Äpfeln vorkommt.
Entscheidend ist die Differenz zwischen pH-Wert und pKs-Wert Sie beträgt in diesem Fall: 6,8 – 5,1 = 1,7. Das Verhältnis Basen zu Säuren ist also weiter in Richtung Basen verschoben als beim Blut. (Bei letzterem sind es ja nur 1,3.)
Wenn wir ein weiteres Mal zur Logarithmen-Tafel greifen, sehen wir: log 10 (50) = 1,7. In diesem Fall ist das Verhältnis Basen zu Säuren also 50:1. Somit erhält das Blut einen Basenüberschuss – den der Körper zur Neutralisierung überschüssiger Säuren verwenden oder in der Leber speichern kann.
Die Henderson-Haselbalch-Gleichung gilt für mittelstarke Säuren: Apfelsäure, Citronensäure, Oxalsäure, Fumarsäure, Weinsäure und viele andere 65, 66, 67. Sie kommen relativ hoch konzentriert in unreifen Früchten vor und verhindern so, dass die Früchte gefressen werden, bevor ihre Samen reif sind. In reifem Obst und Gemüse sind gewöhnlich 1 bis 3 % enthalten.
Jede mittelstarke Säure, bei der die Differenz zwischen pH und pKs größer ist als 1,3, führt dem Körper mehr Basen als Säuren zu. Das ist der Grund, weshalb die leicht sauren Pflanzen so gesund sind. Es war Hans-Heinrich Jörgensen, der darauf hingewiesen hat 58.
Bei Obst- und Gemüsesäften hat man mit festen Zellsubstanzen natürlich auch neutralisierende Stoffe von der Zellflüssigkeit der Pflanzen getrennt. Der Saft ist deshalb oft zu sauer für den Magen, weshalb es sinnvoll oder notwendig ist, ihn zu verdünnen. Die „Schorle“ ist also eine gute Idee – solange man geeignetes Wasser dafür verwendet.
Natürlich kann man dem Körper auch Nahrung zuführen, die von vornherein basisch ist. Eine der ersten Methoden der Chemie, saure und basische Lösungen zu erkennen, war der Geschmack. Saures schmeckt sauer, Basisches schmeckt bitter.
Bitterstoffe liegen nicht im Trend. Man bevorzugt Süßes. So hat man Bitterstoffe – ebenso wie Säuren – weitgehend aus den Pflanzen herausgezüchtet. Doch Bitterstoffe pflegen die Darmwand, regen die Verdauung an – und liefern dem Körper Basen 107.
Wie das Blut, so das Wasser
Die Frage nach dem idealen pH-Wert von Trinkwasser erledigt sich eigentlich von selbst, wenn man bedenkt, dass reines Wasser (aufgrund seiner Reaktion mit dem Kohlendioxid der Umgebung) stets eine leicht saure Tendenz aufweist.
Künstlich hergestelltes stark basisches Wasser („Basenwasser“) könnte durchaus als Medizin (als „Antioxidans“ - siehe unten) verwendet werden, auf die Dauer jedoch wären unkalkulierbare Blutveränderung zu erwarten 72. Das Blut als solches ist sauer. Der Körper sollte deshalb genauso wenig Basen wie Mineralstoffe über das Wasser erhalten. Es handelt sich dabei nicht um Aufgaben, die dem Wasser zukämen. Wasser hat viele Funktionen, doch es ist kein Nahrungsmittel.
Das Münchener Leitungswasser hat einen durchschnittlichen pH-Wert von 7,4. Unter den Mineralwässern hat bsw. das französische „Lauretana“ 6,6 54, ebenso wie das italienische „Plose“106. Vincent empfiehlt einen leicht sauren pH-Wert zwischen 6,2 und 6,8. Die Trinkwasserverordnung lässt einen Bereich zwischen 6,5 und 9,5 zu 55.
3. Redoxpotential
Wenn wir pH-Werte des Wassers untersuchen, beschäftigen wir uns mit der Aktivität der Protonen, wenn wir uns das Redoxpotential des Wasser anschauen, befassen wir uns mit der Aktivität der Elektronen des Wasserstoffs.
Der Begriff „Oxidation“ (vom neulat. „Oxygenium“, Sauerstoff) wurde ursprünglich für Reaktionen verwendet, bei denen sich Sauerstoff mit einer anderen Substanz verbindet. Unter „Reduktion“ (vom lat. „reductio“, das Zurückführen; zu „reducere“, zurückführen) verstand man umgekehrt die Entfernung von Sauerstoff aus irgendwelchen Verbindungen.
Die Definitionen wurden mittlerweile erweitert 73. Oxidation ist heute der Vorgang, bei dem ein Atom ein oder mehr Elektronen abgibt:
A → A+ + e-
In Worten: Der Stoff A gibt ein Elektron ab (das „e-“ ist die negative Ladung des Elektrons). Der Stoff A ist nun positiv geladen.
Reduktion ist der Vorgang, bei dem ein Atom Elektronen aufnimmt. Das ist meistens allerdings immer noch der Sauerstoff:
B + e- → B-
In Worten: Der Stoff B nimmt ein Elektron auf. Deshalb ist er nun negativ geladen.
Oxidation ist Elektronenverlust, Reduktion Elektronengewinn. Das Oxidationsmittel wird „reduziert“ (erhält Elektronen), das Reduktionsmittel wird „oxidiert“ (verliert Elektronen).
Oxidation ist jedoch nicht ohne Reduktion möglich, und umgekehrt. Wenn irgendwo Elektronen übernommen werden, müssen sie irgendwo verloren gehen. Reduktion und Oxidation sind also Teilreaktionen einer Gesamtreaktion: der Reduktions-Oxidations-Reaktion oder kurz Redoxreaktion:
A + B → A+ + B-
Ergebnis: A + B → AB
In Worten: Stoff A gibt ein Elektron an Stoff B ab. Beide bilden die Verbindung AB.
Ein Beispiel ist die Verbrennung von Holz, Kohle oder Erdöl, bei der Kohlenstoff zu Kohlendioxid oxidiert wird.
Oxidation: Kohlenstoff gibt pro Atom 4 Elektronen ab:
C → C4+ + 4e-
Reduktion: Zwei Atome Sauerstoff nehmen jeweils 2 Elektronen auf.
O2 + 4e- → 2 O2-
Redoxreaktion: Sauerstoff oxidiert den Kohlenstoff und wird dabei selbst reduziert. Kohlenstoff reduziert den Sauerstoff und wird dabei selbst oxidiert:
C + O2 → C4+ + 2 O2-
Ergebnis: C + O2 → CO2
Sauerstoff ist das Element, das nach Fluor über die stärksten Bindungskräfte („Elektronegativität“) verfügt. Sauerstoff kann daher sehr aggressiv wirken. Wenn Eisen oder Stahl rosten, hat das mit Sauerstoff zu tun. Wenn frisch geschnittene Äpfel innerhalb von Minuten bräunlich werden, ist das darauf zurückzuführen, dass sie durch den Luftsauerstoff oxidiert worden sind. Feuer ist eine besonders heftige Redoxreaktion mit Sauerstoff als Oxidationsmittel, wobei Licht und Wärme frei werden.
Redoxsysteme
Ein Redoxsystem ist eine Mischung aus Stoffen, die je nach Lage reduzierende, oxidierende oder neutrale Wirkung hat 64. Das Redoxpotential des Systems hängt ab vom Mischungsverhältnis der beteiligten Stoffe und ihrer Neigung, andere Stoffe zu oxidieren 74. Wasser bildet solche Systeme.
Wasser besteht aus Wasserstoff und Sauerstoff: aus Wasser-Molekülen, aus Oxonium- und Hydroxid-Ionen und aus molekularem Wasserstoff und Sauerstoff. Im sauberen Wasser eines naturbelassenen Bachs oder Sees liegen diese Moleküle und Ionen etwa im Gleichgewicht vor:
H2 - H3O+ - H2O - OH- - O2
Wasserstoff – Oxonium – (reines) Wasser – Hydroxid – Sauerstoff 75
Das System reagiert neutral. Störungen des Gleichgewichts verändern jedoch sein Redoxpotential. Mehr Stoffkonzentrationen auf der linken Seite fördern das reduzierende Vermögen, mehr Stoffkonzentrationen auf der rechten Seite das oxidierende Vermögen des Wassers. Gestörte Systeme sind kranke Systeme, in denen das Leben geschädigt wird oder zugrunde geht.
Ähnliches gilt für die wässrigen Systeme von Organismen: das System der Körperflüssigkeiten als Ganzes und das Blut als Teilsystem. Gestörte Systeme lassen Störungen und Krankheiten entstehen.
Potentiale
Das Redoxpotential einer Wasserprobe ist ihre Fähigkeit, Elektronen abzugeben oder aufzunehmen. H2-Moleküle können Elektronen abgeben. Ein Übergewicht der H2-Konzentration bedeutet daher einen Elektronenüberschuss des Wassers. O2-Moleküle können Elektronen aufnehmen. Ein Übergewicht der O2-Konzentration bedeutet deshalb einen Elektronenmangel des Wassers.
Wir können das Mischungsverhältnis von H2- und O2-Molekülen feststellen, indem wir die elektrische Spannung messen, die zwischen einer im Wasser platzierten Elektrode und einer Standard-Referenz-Elektrode besteht. Die Referenz (vom lat. „referre“, zurücktragen; sich auf etwas beziehen) ist der Bezugspunkt; und es ist ein Standard-Bezugspunkt, weil er der Nullpunkt der Potentialskala ist (die sogenannte „Standard-Wasserstoffelektrode“). Heutzutage gibt es dafür allerdings handliche Messgeräte.
Jede elektrische Spannung hat, wie jeder Bach und jeder Fluss, ein Gefälle; und sie fließt in die Richtung, die das Gefälle vorgibt. Eine Spannung von 12 Volt (V) zwischen den beiden Polen einer Autobatterie hat ein steileres Gefälle als eine Spannung von 1,5 V zwischen den Polen der Batterie einer Taschenlampe. Spannungen, die im Zusammenhang mit Redoxpotentialen des Wassers messbar sind, liegen im Bereich von maximal ein paar hundert Millivolt (mV: vom lat. „mille“, tausend: Tausendstel-Volt).
Im Unterschied zu den Bächen oder Flüssen jedoch kann sich das Gefälle von Redoxpotentialen umkehren 79. So beobachten wir bei eine Elektronenüberschuss des Wassers ein Gefälle, das vom Wasser zum Bezugspunkt hin abfällt. Wir messen bsw. eine Spannung von -100mV. Der Elektronenüberschuss wird „angezapft“ (daher das MinusZeichen). Bei einem Elektronenmangel des Wassers haben wir es mit einem Gefälle vom Bezugspunkt zum Wasser hin zu tun. Wir messen bsw. +200 mV. Die Elektronen bewegen sich nun also in die andere Richtung (daher das Plus-Zeichen).
Stehendes Gewässer hat kein Gefälle. Ebenso gibt es keine Spannung, wenn sich die H2- und O2-Konzentrationen die Waage halten 80. Eine Messung im Blut eines gesunden Menschen würde einen leicht negativen Wert ergeben. Es besteht also ein leichter Elektronenüberschuss. Mit den verwendeten Messgeräten wird aber nicht die durch die H2- Konzentration bewirkte Spannung, sondern die H2-Konzentration selbst gemessen (siehe unten).
Der rH2-Wert
(Das „r“ steht für „Redoxpotential“. Das „H2“ steht für „molekularen Wasserstoff“: das 2-atomige Gasmolekül, wie es im Wasser gelöst vorkommt. Der „rH2-Wert“ ist also der Wert des Redoxpotentials, ausgedrückt als Konzentration von molekularem Wasserstoff.)
Die Konzentration eines Gases wird jedoch oft, im Gegensatz zu Feststoffen und Flüssigkeiten, in Form seines „Partialdrucks“ (lat. „pars“, Gen. „partis“, Teil) angegeben 76. Druck ist eine Kraft, die senkrecht auf eine Bezugsfläche, z. B. die Erdoberfläche, mit einem bestimmten Flächeninhalt, z. B. 1 m², wirkt 77. Der Partialdruck ist der Druck, der sich in einem Gasgemisch, wie z. B. Luft, einem bestimmten Gas zuordnen lässt.
Beispiel: Der Gesamtdruck der Luft auf Meereshöhe beträgt ca. 1013 hPa (Hekto-Pascal: eine Maßeinheit des Drucks). Stickstoff macht ungefähr 78 % der Luft aus und hat einen Partialdruck von 791 hPa. Sauerstoff macht 21 % aus und hat einen Partialdruck von 212 hPa.
Eine alte Maßeinheit des Drucks ist die Atmosphäre (Atm), wobei gilt: 1 Atm = 1013 hPa 78. 1 Atm ist also der Luftdruck (der Druck der „Atmosphäre“) auf Meereshöhe. Er entspricht etwa dem Druck, den eine Masse von 1 kg auf 1 cm2 ausübt. Die Atm wurde verwendet, um die Konzentration von H2 im Wasser zu messen und eine rH2-Skala zu konstruieren.
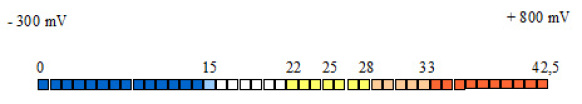
Die rH2-Skala
Die rH2-Skala reicht von 0 bis 42,5 63. Die Skalenwerte sind, wie bei der pH-Skala, negative Logarithmen, mit -1 multipliziert – nur dass es hier nicht um mol/L, sondern um Atm geht.
Ein H2-Druck von 1 Atm bedeutet, dass der Druck des im Wasser gelösten H2 genau dem Luftdruck entspricht: 1 Atm = 100 Atm; deshalb ist der Skalenwert 0. Ein H2-Druck von 0,1 Atm heißt, dass der Druck des im Wasser gelösten H2 1/10 des Luftdrucks ausmacht: 0,1 Atm = 10-1 Atm; also ist der Skalenwert 1. Ein H2-Druck von 0,01 Atm heißt, dass der Druck des im Wasser gelösten H2 1/100 des Luftdrucks beträgt: 0,01 Atm = 10-2 Atm; also ist der Skalenwert 2. Usw.
Mit dem H2-Druck, d. h. der Konzentration an H2, geht ein entsprechender O2-Druck, d. h. eine entsprechende Konzentration an O2, einher. Mit zunehmender H2-Konzentration sinkt die O2-Konzentration; mit zunehmender O2-Konzentration sinkt die H2-Konzentration. Daher ist – ähnlich wie im Falle von pH- und pOH-Skala – eine rO2-Skala mit der rH2-Skala verbunden. Der Wert 0 der rO2-Skala entspricht dem Wert 42,5 der rH2-Skala; der Wert 42,5 der rO2-Skala entspricht dem Wert 0 der rH2-Skala. Man arbeitet aber in erster Linie mit der rH2-Skala – wie man gewöhnlich die pH-Skala verwendet.
Der Neutralitätspunkt der rH2-Skala liegt bei 28. Niedrigere Werte drücken ein reduzierendes, höhere Werte ein oxidierendes Potential aus. Für den menschlichen Organismus liegt das physiologische Mittel bei 25. Die Grenzen der Lebensfähigkeit liegen bei 15 auf der einen und bei 33 auf der anderen Seite (siehe Abbildung 5).
Abb. 5: rH2-Skala. Erläuterungen im Text.
Die Auswirkungen
Erhöhte rH2-Werte, sprich oxidative Tendenzen, des Bluts sind verbunden mit Degeneration (vom lat. „degenerare“, entarten: Verfall von Zellen, Geweben und Organen), Sklerose (vom grch. „skleros“, trocken, spröde, hart + „-ose““, Wortendung mit der Bedeutung „Krankheit“: krankhafter Elastizitätsverlust, Verhärtung von Geweben und Organen), Tumor bildenden und bösartigen Prozessen 63. Erkrankungen dieser Art brauchen gleichzeitig alkalische pH-Werte.
Erniedrigte rH2-Werte, d. h. reduzierende Tendenzen, des Bluts gehen einher mit Entzündungen und Infektionen – die auch ein saures Milieu brauchen.
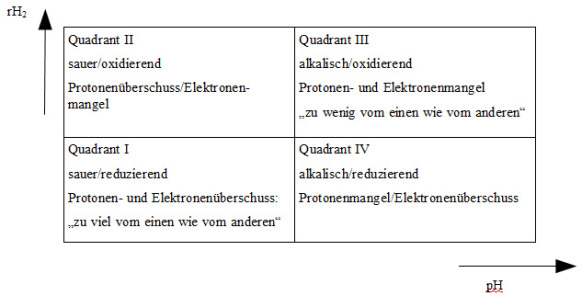
Wenn man die pH-Skala als horizontale Achse und die rH2-Skala als vertikale Achse eines Diagramms verwendet, erhält man die vier Quadranten von Abbildung 6:
Abb. 6: Die vier Quadranten von pH-Skala und rH2-Skala.
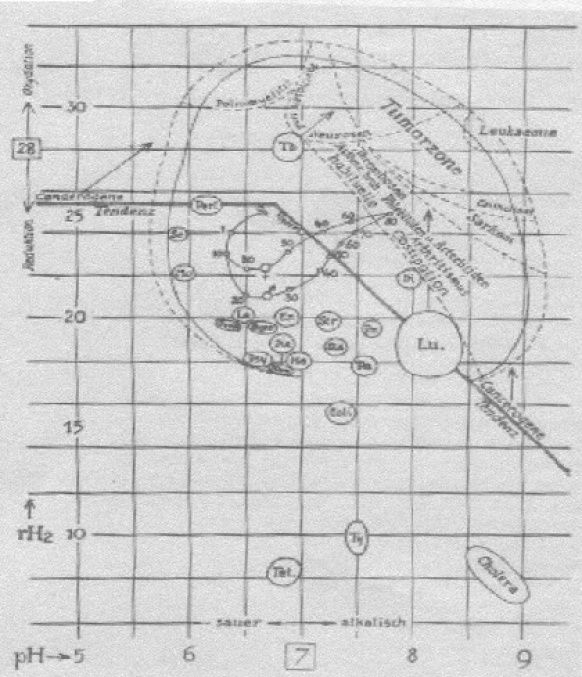
Die wichtigsten Erkenntnisse Vincents dazu sind in der von ihm selbst angefertigten Abbildung 7 enthalten – ein echtes Zeugnis der Wissenschafts-geschichte also. Es zeigt die Tumorzone rechts oben, im III. Quadranten, ebenso wie die Mehrzahl der modernen Zivilisationskrankheiten, z. B. Asthma, Erkran-kungen der Blutgefäße, Thrombosen und Störungen des Magen/Darmtrakts 62. Entzündliche und Infektionskrankheiten liegen genau gegenüber, im I. Quadranten.
Das wimpelförmige Gebilde in der Mitte zeigt die Entwicklung der pH- und rH2-Werte über die Lebensspanne hinweg. Die obere Begrenzungslinie des Wimpels ist die Linie der Frau, die untere die des Mannes. Vincent beobachte also Unterschiede zwischen den Geschlechtern und für beide eine leichte Verschiebung des pH-Werts im Laufe der Zeit in die alkalische Richtung - wie sie vor ihm schon von Brehmer in den 1930-er Jahren festgestellt hatte.
Gesundheit spielt sich in einem Kreis in der Mitte der Abbildung ab. Die untere Hälfte des Kreises wird in etwa von dem eben beschriebenen Wimpel gebildet. Der Kreis wird erkennbar ungefähr zwischen pH 6,2 und 7,5 und rH2 22 und 28.
Wasserstoff spielt eine wesentliche Rolle bei der Speicherung der aus dem Stoffwechsel gewonnenen Energie 83-89. Sie wird in speziellen Molekülen untergebracht, auf die zurückgegriffen wird, wann und wo immer für irgendeine Reaktion Energie gebraucht wird. Der meiste Wasserstoff stammt sicherlich aus der Aufspaltung der Glucose (siehe S. 1). Doch offensichtlich ist ein leichter Elektronenüberschuss des Bluts unentbehrlich 90.
„Reduzierend“ ist ein anderes Wort für „antioxidativ“ 81. Reduzierendes Wasser wirkt daher als Radikalenfänger. (Freie) Radikale sind Stoffe, die u. a. mit minderwertiger Nahrung aufgenommen werden oder bei der Verdauung entstehen und die körpereigene Substanzen oxidieren 82. Sie entreißen den Körperzellen Elektronen, wodurch Zellschäden entstehen und Alterungsprozesse beschleunigt werden. Wasser mit leicht reduzierender Wirkung macht freie Radikale unschädlich, indem es ihren Elektronenhunger stillt.
Abb. 7: pH- und rH2-Blutwerte nach Vincent.
Die Schutzfunktion
Trinkwasser sollte offensichtlich leicht reduzierend/antioxidativ sein. Unter den Mineralwässern hat „Lauretana“ einen Wert von 24,70, „Plose“ von 27 106. Vincent empfiehlt den Bereich zwischen 22 und 28. In der Trinkwasserverordnung sind rH2- Werte nicht erwähnt.
Ein Schlusswort
Vincent war ein Nachfolger Claude Bernards auf dem Lehrstuhl für Anthropologie (vom grch. „anthropos“, Mensch +„logos“, Wort; Lehre: die Lehre vom Menschen, Menschenkunde) der Universität Paris 62. Von Bernard, der als kritischer Zeitgenosse Louis Pasteurs bekannt war, stammt der Ausspruch: „Le microbe n'est rien, le terrain c'est tout!“ („Die Mikrobe hat keine Bedeutung, das Terrain ist alles, worauf es ankommt.“)
Was meinte er damit? Natürlich ist die „Mikrobe“ (der Mikroorganismus: das Bakterium, der Schimmelpilz oder die Hefe) die unmittelbare Ursache der Infektion – und es ist gut, dass Pasteur uns das mitgeteilt hat. Doch wir leben in einer Welt voller Leben, wenn wir uns gewöhnlich auch nur dessen bewusst sind, was wir unmittelbar wahrnehmen – weshalb wir auch ständig dabei sind, den Rest zu zerstören. Wir essen täglich Unmengen an Bakterien; wir atmen ständig irgendwelche Viren ein und aus. Doch sie können uns nur gefährlich werden, wenn wir ihnen ihr Terrain bieten – wobei wir beim Wasser besser vom Milieu sprechen. Das war Bernards Erkenntnis - und Vincent baute darauf auf. Wasser bestimmt das innere Milieu des Körpers.
Wasser allein wird nicht die Abhilfe für jede Krankheit sein können. Doch ohne ausreichende Mengen an geeignetem Wasser wird eine Erholung kaum möglich sein. Wie sollte sich ein wässriges System erholen, solange das Wasser selbst das erste Problem ist?
Einigen Leuten scheint das durchaus einzuleuchten. Doch sei es aus Knauserigkeit oder Bedenken vor den Reaktionen der Gattin, die von derlei „Blödsinn“ nichts wissen will, sie verwenden geeignetes Wasser nur – für sich persönlich - als Getränk. Der Kaffee, der Tee und die Suppen werden weiterhin (von ihr) mit Kalkwasser hergestellt ...
Wasser ist nicht alles, aber vieles bringt nicht viel ohne Wasser. Wasser kann nicht mehr und nicht weniger sein als ein erster Schritt. Gemeint ist Wasser mit den Werten:
-
Elektrische Leitfähigkeit: < 160 μs/cm
-
pH-Wert: 6,2 bis 6,8
-
Redoxpotential: 22 bis 28 91
Es handelt sich dabei eigentlich um nichts Besonderes. Es sind die Werte von Wasser, das zum einen kein Oberflächengestein durchflossen hat und das zum anderen nicht vom Menschen verunreinigt worden ist – oder aus dem man mit vernünftigen Methoden entfernt hat, was nicht hineingehört.
Ein Blick in die Regale
Es besteht ein enger Zusammenhang zwischen pH-Wert und rH2-Wert, insofern ein leicht sauerer pH-Wert gewöhnlich mit einem leicht reduzierenden/antioxidativen rH2 - Wert einhergeht. Auf die Berechnung von rH2-Werten wurde deshalb in der folgenden Tabelle verzichtet, zumal sie praktisch nie vom Abfüller angegeben werden. Rot gedruckt sind aus anderen Werten geschätzte Werte; sie werden also stets mehr oder weniger von den tatsächlichen Werten abweichen 92-104, 108, 109.
|
Name |
Elektr. Leitf. in μs/cm |
Spez. Widerst. in Ω ∙ cm |
pH-Wert |
Festrückstand in mg/L |
|
Destilliertes Wasser |
2 |
500.000 |
7,0 |
0 |
|
Montcalm |
14 |
71.000 |
6,6 |
10 |
|
Lauretana |
17,6 |
56.800 |
6,56 |
14,0 |
|
Mont Rouccous |
20 |
50.000 |
5,85 |
25 |
|
Regenwasser |
25 |
40.000 |
|
18 |
|
Plose |
27 |
37.000 |
6,6 |
22,0 |
|
Black Forest |
54 |
18.500 |
6,8 |
35,8 |
|
Hornberger Lebensquell |
58,0 |
17.200 |
6,10 |
54,0 |
|
Vaia |
163,0 |
6.135 |
8,1 |
110,2 |
|
Balda |
175,0 |
5.714 |
8,1 |
114,0 |
|
Volvic |
190 |
5.263 |
6,9 |
133 |
|
Maniva |
219,0 |
4.566 |
7,5 |
141,0 |
|
Aqua Panna |
221,0 |
4.525 |
8,1 |
144,0 |
|
Pineo |
250 |
4.070 |
7,29 |
172 |
|
Vittel |
279 |
3.580 |
7,5 |
200 |
|
Artesia |
310 |
3.230 |
7,19 |
203,72 |
|
Luna |
320,0 |
3.125 |
7,4 |
228,0 |
|
Mozartquelle still |
351 |
2.850 |
6,16 |
246 |
|
ViO still |
355 |
2.817 |
7,7 |
249 |
|
Kneipp |
361 |
2.770 |
7,7 |
253 |
|
ViO blue still |
397 |
2.519 |
7,4 |
278 |
|
Saskia still |
549 |
1.820 |
7,5 |
384 |
|
St. Leonards Quelle |
615 |
1.630 |
7,25 |
339 |
|
Ammertaler Alpin still |
650 |
1.538 |
7,5 |
455 |
|
Aqua Luna |
676 |
1.480 |
7,45 |
373 |
|
Adelholzener Naturell |
800 |
1.250 |
|
560 |
|
Nestle Aquarel Medium |
969 |
1.030 |
5,8 |
678 |
|
San Pellegrino |
1.195 |
836,8 |
7,84 |
959,0 |
|
Gerolsteiner Naturell |
1.260 |
790 |
6,9 |
885 |
|
Franken Brunnen still |
2.060 |
490 |
|
1.441 |
|
Appolinaris Classic |
3.910 |
260 |
|
2.740 |
|
Überkinger Classic |
5.440 |
180 |
|
3.809 |
|
Meerwasser |
50.000 |
20 |
|
35.000 |
Wahrscheinlich wären nicht nur einige, sondern die allermeisten der obigen Mineralwässer von exzellenter Qualität, wenn man nur die Mineralstoffe daraus entfernte – wenn man aus Mineralwasser Wasser machen würde.
Verunreinigungen und Vergiftungen
Zunehmend Probleme bereiten allerdings Verunreinigungen und möglicherweise daraus resultierende Vergiftungen des Wassers durch Pestizide, Klärschlamm, Waschmittel, Plastik und Arzneimittelrückstände.
Unser Trinkwasser stammt entweder aus Oberflächenwasser (Flüsse und Seen), Grundwasser oder Quellwasser. Am gefährdetsten ist natürlich das Oberflächenwasser.
Was bei uns aus der Wasserleitung kommt, ist meist Grundwasser. Es gibt jedoch auch Regionen, z. B. das Ruhrgebiet oder Berlin, in denen vorwiegend oder fast ausschließlich Uferfiltrat verwendet wird. Es stammt aus Brunnen in unmittelbarer Nähe von Flüssen oder Seen, deren Wasser zu einem erheblichen Teil aus dem entsprechenden Oberflächenwasser besteht. Arzneimittelrück-stände lassen sich bereits im Leitungswasser einer ganzen Reihe von Städten finden, die ihr Trinkwasser aus solchen Brunnen beziehen.
Die Effizienz der pharmazeutischen Industrie ist also überaus bescheiden, wenn sich ihre Produkte aufgrund der Ausscheidungen ihrer Konsumenten mittlerweile im Leitungswasser wiederfinden lassen, während die Konsumenten immer kränker werden.
Eine besondere Gefahr für unser Trinkwasser heißt Fracking (kurz für engl. „Hydaulic Fracturing“, eigentlich „das Aufbrechen (von Gestein) durch Druckwasser“110. Dabei wird ein Mix aus Wasser, Sand und Chemikalien mit Hochdruck durch Bohrlöcher in den Untergrund gepresst, um Erdöl- oder Erdgasvorräte freizusetzen. Die Flüssigkeit bricht die Gesteinsschichten auf, der Sand füllt die Zwischenräume, und das Öl bzw. Gas kann entweichen.
Ursprünglich wurde Fracking eingesetzt, um bestehende Lagerstätten auszuräumen; im sogenannten „unkonventionellen Fracking“ jedoch werden damit neue Lagerstätten erschlossen. Die Risiken sind unabsehbar. Sie werden vermutlich zuerst in den USA zu beobachten sein, wo Fracking bereits am längsten und intensivsten betrieben wird.
Abb. 8: Fracking in North Dakota, USA: offene Grube mit Schlamm aus dem Rückfluss-wasser einer Bohrung.
Man möchte nun auch in Deutschland an dieser Art von „Fortschritt“ teilhaben 111. „In einer ursprünglichen Fassung sah das Fracking-Gesetz ein Verbot bis 3.000 Meter Tiefe vor. Dieses wurde nun gestrichen. Der Kompromiss kam unter Vermittlung von Kanzleramtsminister Peter Altmaier (CDU) auf Betreiben des Wirtschaftsflügels der CDU, der Gewerkschaft IG Bergbau, Chemie, Energie sowie dem Bundesverband der Deutschen Industrie zustande. Das Gesetzt soll noch in diesem Jahr im Bundestag beschlossen werden“ (Spiegel online vom 15.11.2014). Der erwähnte Kanzleramtsminister war vorher übrigens Umweltminister.
_________________________
Unsere Umwelt zu zerstören heißt auch zu zerstören oder verderben, was wir ihr entnehmen, um zu überleben: die Luft, die wir atmen, die Nahrung, die wir essen - und das Wasser, das wir trinken. Das ist im Grunde sehr einfach. Doch es ist charakteristisch für uns, dass die meisten nicht in der Lage sind, die einfachen Zusammenhänge zu erkennen, und dass die wenigen, denen sie klar sind, nicht auf die Idee kommen, dass es für die meisten nicht so ist.
□
Literatur
Batmandhelidj, Fareydoon (2012). Sie sind nicht krank, Sie sind durstig. Heilung von innen mit Wasser und Salz. Kirchzarten: VAK-Verlag, 12. Aufl.
Emoto, Masaru (2002). Die Botschaft des Wassers. Burgrain: KOHA-Verlag, 2. Aufl.
Lippert, Herbert (2000). Lehrbuch Anatomie. München, Jena: Urban & Fischer, 5. Aufl.
Mortimer, Charles, E. & Müller, Ulrich (2001). Chemie. Das Basiswissen der Chemie. Stuttgart: Thieme, 7. Aufl.
Zeitschriften und Broschüren
Öko-Test 9/2014
Stadtwerke München (ohne Jahresangabe). M-Wasser. Ein erstklassiges Naturprodukt.
Bilder
Abbildungen 1, 2, 4 und 8 unterliegen der Gemeinfreiheit („Public Domain“).
Autor von Abbildung 1 ist Solid State:
File:NaCl polyhedra.png - Wikimedia Commons
Autor von Abbildung 2 ist Raimund Apfelbach:
File:Wasserstoffbrückenbindungen-Wasser.svg - Wikimedia Commons
Autor von Abbildung 4 ist Patricia R:
File:PHscalenolang.svg - Wikimedia Commons
Autor von Abbildung 8 ist Joshua Doubek:
http://commons.wikimedia.org/w/index.php?title=User:Joshua_Doubek&action=edit&redlink=1
Abbildung 7: Verwendung genehmigt von Dr. Karl Braun-von Gladiß.
Web-Links
1 - Faridun Batmanghelidj - Biographie des iranischen Arztes.
2 Louis-Claude Vincent - Wikipédia
5 Sedimente und Sedimentgesteine – Wikipedia
13 Calciumcarbonat – Wikipedia
15 Magnesiumcarbonat – Wikipedia
17 Liste der Atommodelle – Wikipedia
18 Schalenmodell (Kernphysik) – Wikipedia
20 Salzbildungsreaktion – Wikipedia
21 Ionische Bindung – Wikipedia
28 Elektrische Leitfähigkeit – Wikipedia
29 Siemens pro Meter... (Elektronik)
33 Chemische Bindung – Wikipedia
34 Wasser als Energie- und Informationsträger - Das IPN
36 www.vb-schick.de/Wasser/Vincenttabelle.pdf
37a http://de.wikipedia.org/wiki/D%C3%BCnger
37b http://de.wikipedia.org/w/index.php?title=Nitrate&action=edit
37c http://de.wikipedia.org/w/index.php?title=Bodenversauerung&action=edit
38 www.wasserinformationen.de/fileadmin/download/pdf/geniales-wasser.pdf
46 Atomare Masseneinheit – Wikipedia
48 Avogadro-Konstante – Wikipedia
49 Avogadrosches Gesetz – Wikipedia
51 Biogas : Messtechnik und Datengewinnung : Parameter pH - Wert
53 pH-Wert - Wasserlexikon | Gerolsteiner Mineralwasser
54 www.mayrandmore.com/tl_files/mm-de/content/news/files/2012/lauretana-de.pdf
55 Trinkwasserverordnung – Wikipedia
56 www.semmelweis.de/pdf/pdf.php?name=06_koerner_grundfrage_deu&ext=pdf
57 Säure-Basen-Haushalt – Wikipedia
58 www.semmelweis.de/pdf/pdf.php?name=07_joergensen_saeure_base&ext=pdf
59 Kohlensäure-Bicarbonat-System – Wikipedia
61 Hyperventilation – Wikipedia
62 www.windstosser.ch/museum/dreifachmessgeraet/sonderdruck.pdf
63 Wasserstoffpotential, Redoxpotential und spezifischer Widerstand des Blutes
64 www.windstosser.ch/museum/themen/saeure_basen/gewebsazidose.pdf
69 Chemie-Rechner: Verdünnung von Basen und Säuren
71 Henderson-Hasselbalch-Gleichung – Wikipedia
72 Fachinformationen: Wasser unser wichtigstes Lebensmittel - colostrum-infos jimdo page!
75 Prof. Blumes Medienangebot: Wasser und Leben
78 Physikalische Atmosphäre – Wikipedia
79 Wasserstoffelektrode – Wikipedia
80 Bio Elektronik nach Vincent Page 13.
81 Wasserionisierer - Redoxpotential
82 Radikale (Chemie) – Wikipedia
83 Glucoseabbau
84 Glycolyse
85 Gärungen
86 Glycolyse
87 Glycolyse
88 Citratzyklus
89 Atmungskette
90 BETA
91 Die Wasserqualität nach Vincent
92 Bio Elektronik nach Vincent Page 17.
93 www.internationale-mineralwaesser.com/pdf/Analyse-SanPellegrino 09.08.06.pdf
94 www.internationale-mineralwaesser.com/pdf/Analyse-Luna-09.01.07.pdf
95 Quellanalyse
96 EIGENSCHAFTEN « PLOSE Natürliches Mineralwasser
97 Wasser
98 Black Forest still - Natürliches Mineralwasser ohne Kohlensäure
99 www.internationale-mineralwaesser.com/pdf/Analyse-Vaia-09.08.06.pdf
100 www.internationale-mineralwaesser.com/pdf/Analyse-Balda-16.04.07.pdf
101 www.internationale-mineralwaesser.com/pdf/Analyse-Panna-09.08.06.pdf
102 www.internationale-mineralwaesser.com/pdf/Analyse Maniva-03.07.07.pdf
103 Empfehlenswerte Wässer - Wasser & Salz
104 Vergleichstabelle - Gerolsteiner Mineralienrechner
105 www.gesetze-im-internet.de/bundesrecht/trinkwv_2001/gesamt.pdf
106 http://www.eco-world.de/scripts/basics/econews/basics.prg?a_no=11975
107 http://www.spitzbarts-gesundheitspraxis.de/gesunde-ernaehrung/ernaehrungstipps/bitterstoffe
108 http://www.mont-roucous.com/article/glossaire
109 http://www.wassertrinken.biz/mineralwaesser.html
110 http://www.spiegel.de/wissenschaft/mensch/fracking-us-studie-belegt-grundwasserverschmutzung-a-1084787.html